浙江省温州市十校联合体2015-2016学年高三下学期理综化学开学考试试卷
试卷更新日期:2018-02-07 类型:开学考试
一、单选题
-
1. 下列说法不正确的是( )A、生物质能来源于植物及其加工产品所存贮的能量,绿色植物通过光合作用将化学能转化成生物质能 B、2015年8月国内油价再次迎来成品油最高零售价的下调,上演了年内首场“四连跌”,但油品从国Ⅳ汽油升级到Ⅴ汽油,有助于减少酸雨、雾霾,提高空气质量 C、我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温下可用金属钠还原四氯化钛来制取金属钛 D、元素分析仪可以确定物质中是否含有C、H、O、N、S、Cl、Br等元素,原子吸收光谱可以确定物质中含有哪些金属2. 为达到相应的实验目的,下列实验的设计或操作最合理的是( )A、往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀 B、在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶中,取出坩埚钳,盖上玻璃片,观察Mg条在集气瓶底部燃烧。 C、为比较Cl与S元素非金属性强弱,相同条件下测定相同浓度NaCl溶液和Na2S溶液的pH值 D、给盛有铜与浓硫酸的试管加热,发现试管底部出现灰白色固体,为检验其中的白色固体为无水硫酸铜,可直接向试管中加入适量水3. A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示.A元素的某种同位素原子没有中子,D元素的原子序数是C的2倍,E是短周期主族元素中半径最大的元素.下列说法不正确的是( )
 A、简单离子的半径大小关系:B>C>E B、D,E两种元素形成的化合物,可能含有离子键和共价键 C、A,B,C三种元素形成的化合物,晶体类型一定相同 D、B,D分别和C形成的化合物,都有可能使溴水或品红溶液褪色4. 下列说法正确的是( )A、最简式为C2H4O的有机物一定可以发生银镜反应 B、不粘锅表面的高分子涂层可以由四氟乙烯通过缩聚反应合成 C、分子结构中含有4个甲基、碳原子数最少的烷烃的系统命名为:2,2﹣二甲基丙烷 D、甘油和甲苯只有在物质的量之比1:1混合时,充分燃烧后生成的水,才与等质量的甘油充分燃烧后生成的水相同5. 乙醛酸(HOOC-CHO)是有机合成的重要中间体。某同学组装了下图所示的电化学装置,电极材料Ⅰ~Ⅳ均为石墨,左池为氢氧燃料电池,右池为用“双极室成对电解法”生产乙醛酸,关闭K后,两极室均可产生乙醛酸,其中乙二醛与Ⅲ电极的产物反应生成乙醛酸。下列说法不正确的是( )
A、简单离子的半径大小关系:B>C>E B、D,E两种元素形成的化合物,可能含有离子键和共价键 C、A,B,C三种元素形成的化合物,晶体类型一定相同 D、B,D分别和C形成的化合物,都有可能使溴水或品红溶液褪色4. 下列说法正确的是( )A、最简式为C2H4O的有机物一定可以发生银镜反应 B、不粘锅表面的高分子涂层可以由四氟乙烯通过缩聚反应合成 C、分子结构中含有4个甲基、碳原子数最少的烷烃的系统命名为:2,2﹣二甲基丙烷 D、甘油和甲苯只有在物质的量之比1:1混合时,充分燃烧后生成的水,才与等质量的甘油充分燃烧后生成的水相同5. 乙醛酸(HOOC-CHO)是有机合成的重要中间体。某同学组装了下图所示的电化学装置,电极材料Ⅰ~Ⅳ均为石墨,左池为氢氧燃料电池,右池为用“双极室成对电解法”生产乙醛酸,关闭K后,两极室均可产生乙醛酸,其中乙二醛与Ⅲ电极的产物反应生成乙醛酸。下列说法不正确的是( ) A、电极Ⅱ上的电极反应式:O2+4e-+2H2O=4OH- B、电极Ⅳ上的电极反应式:HOOC-COOH+2e-+2H+=HOOC-CHO+H2O C、乙二醛与Ⅲ电极的产物反应生成乙醛酸的化学方程式: Cl2 + OHC-CHO+ H2O = 2HCl+ HOOC-CHO D、若有2 mol H+ 通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1 mol6. 已知草酸为二元弱酸:H2C2O4 HC2O4-+ H+ Ka 1 ; HC2O4- C2O42-+ H + Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )
A、电极Ⅱ上的电极反应式:O2+4e-+2H2O=4OH- B、电极Ⅳ上的电极反应式:HOOC-COOH+2e-+2H+=HOOC-CHO+H2O C、乙二醛与Ⅲ电极的产物反应生成乙醛酸的化学方程式: Cl2 + OHC-CHO+ H2O = 2HCl+ HOOC-CHO D、若有2 mol H+ 通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1 mol6. 已知草酸为二元弱酸:H2C2O4 HC2O4-+ H+ Ka 1 ; HC2O4- C2O42-+ H + Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )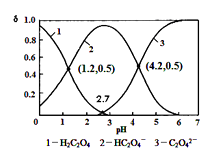 A、常温下,Ka1 :Ka2 =1000 B、将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得 pH为4.2的混合液 C、pH=1.2 溶液中:c(K + ) + c(H + ) = c(OH-) + c(H2C2O4) D、向 pH=1.2 的溶液中加 KOH 溶液将pH增大至4.2的过程中水的电离度一直增大7. 固体粉末X中可能含有K2SO3、K2CO3、FeO、Fe2O3、MnO2、Na2SO4、NaNO3中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下
A、常温下,Ka1 :Ka2 =1000 B、将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得 pH为4.2的混合液 C、pH=1.2 溶液中:c(K + ) + c(H + ) = c(OH-) + c(H2C2O4) D、向 pH=1.2 的溶液中加 KOH 溶液将pH增大至4.2的过程中水的电离度一直增大7. 固体粉末X中可能含有K2SO3、K2CO3、FeO、Fe2O3、MnO2、Na2SO4、NaNO3中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下
根据上述实验,下列说法正确的是 ( )
A、固体X中一定含有Fe2O3 B、沉淀E可能含有BaSO3 C、气体A,C一定均为纯净物 D、固体X可能出现含有K2SO3、K2CO3而不含Na2SO4的情况二、推断题
-
8. 已知:2RCOOH+2CH2=CH2+O2
 2CH2=CHCOOCR+2H2O
2CH2=CHCOOCR+2H2O2RCOOH+2CH2=CH2+O2
 2CH2=CHOOCR+2H2O
2CH2=CHOOCR+2H2O葡萄糖在酒化酶的作用下生成有机物A;B是石油化学工业最重要的基础原料。A、B、C、D、E间的转化关系如下图:
 (1)、写出D中官能团的名称是。(2)、写出A→B的化学方程式。(3)、E的结构简式。(4)、A和C在浓硫酸催化下可发生反应生成F,写出化学方程式。(5)、写出C的同分异构体(与F结构和化学性质相似)。
(1)、写出D中官能团的名称是。(2)、写出A→B的化学方程式。(3)、E的结构简式。(4)、A和C在浓硫酸催化下可发生反应生成F,写出化学方程式。(5)、写出C的同分异构体(与F结构和化学性质相似)。三、实验题
-
9. Ⅰ.某钠盐溶液中通入足量氨气,无明显现象.再在所得溶液中通入过量CO2 , 产生大量白色沉淀。(1)、写出氨气的电子式。(2)、该钠盐溶液中一定不可能含有下列哪种微粒 (填编号)。A、Cl﹣ B、Fe2+ C、SiO32﹣ D、AlO2﹣(3)、写出一个通入过量CO2时生成白色沉淀的离子方程式。(4)、Ⅱ.电镀工业中往往产生大量的有毒废水,必须严格处理后才可以排放.某种高浓度有毒的含A离子(阴离子)废水在排放前的处理过程如下:

已知:9.0g沉淀D在氧气中灼烧后,产生8.0g黑色固体,反应后的气体通过足量澄清石灰水时,产生10.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标况下密度为1.25g/L的气体1.12L。
沉淀D的化学式是。
(5)、写出沉淀D在氧气中灼烧发生的化学方程式。(6)、滤液C中还含有微量的A离子,通过反应②,可将其转化为对环境无害的物质,试用离子方程式表示该原理。(7)、反应①为制得某种元素的低价X离子,从氧化还原反应的角度分析,(填“能”或“不能”用Na2SO3溶液来代替B溶液,原因是。(8)、设计实验证明所用Na2SO3溶液是否变质。10. 高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:MnO2熔融氧化:3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
20℃
K2CO3
KHCO3
K2SO4
KMnO4
s(g/100g水)
111
33.7
11.1
6.34
已知K2MnO4溶液显绿色,KMnO4溶液紫红色。
实验流程如下:

请回答:
(1)、步骤①应在 中熔化,并用铁棒用力搅拌,以防结块。A、烧杯 B、蒸发皿 C、瓷坩埚 D、铁坩埚(2)、①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是。A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是。
③下列监控K2MnO4歧化完全的方法或操作可行的是。
A.通过观察溶液颜色变化,若溶液颜色由绿色完全变成紫红色,表明反应已歧化完全
B.取上层清液少许于试管中,继续通入CO2 , 若无沉淀产生,表明反应已歧化完全
C.取上层清液少许于试管中,加入还原剂如亚硫酸钠溶液,若溶液紫红色褪去,表明反应已歧化完全
D.用pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,表明反应已歧化完全
(3)、烘干时,温度控制在80℃为宜,理由是。(4)、通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。①实验时先将草酸晶体(H2C2O4·2H2O)配成标准溶液,实验室常用的容量瓶的规格有100mL、250mL等多种,现配制90mL 1.5mol·L-1的草酸溶液,需要称取草酸晶体的质量为g。[已知Mr(H2C2O4·2H2O)=126]
②量取KMnO4溶液应选用(填“酸式”或“碱式”)滴定管,若该滴定管用蒸馏水洗净后未润洗,则最终测定结果将(填“偏大”、“偏小”或“不变”)。
四、填空题
-
11. 工业生产硝酸铵的流程如下图所示:
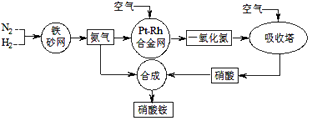 (1)、硝酸铵的水溶液呈(填“酸性”、“中性”或“碱性”);其水溶液中各离子的浓度大小顺序为:。(2)、已知N2(g)+3H2(g) 2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。
(1)、硝酸铵的水溶液呈(填“酸性”、“中性”或“碱性”);其水溶液中各离子的浓度大小顺序为:。(2)、已知N2(g)+3H2(g) 2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。
①曲线a对应的温度是。
②关于工业合成氨的反应,下列叙述正确的是。
A.及时分离出NH3可以提高H2的平衡转化率
B.P点原料气的平衡转化率接近100%,是当前工业生产工艺中采用的温度、压强条件
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
D.如果N点时c(NH3)=0.2 mol·L-1 , N点的化学平衡常数K≈0.93
(3)、尿素(H2NCONH2)是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为二步反应:第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272 kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138 kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:
(4)、某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下左图所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第步反应决定,总反应进行到min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)= 。
③在上面右图中画出第二步反应的平衡常数K随温度的变化的示意图 。
-