-
1、下列离子反应方程式正确的是( )A、Na与水反应: B、氢氧化钡溶液中加入少量碳酸氢钠溶液: C、醋酸除水垢: D、CuO与稀盐酸反应:
-
2、我国科学家成功合成了世界上首个含五氮阴离子的盐,局部结构如图,其中含有两种10e-离子、一种18e-离子。X、Y、Z、M为原子序数依次增大的短周期元素,且均不在同一族。下列说法不正确的是( )
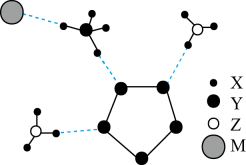 A、该物质中存在离子键、极性共价键和非极性共价键 B、X、Y、M与Z均至少能形成两种化合物 C、Y的最简单氢化物与其最高价氧化物的水化物反应生成的化合物属于离子化合物 D、Y、Z、M对应的最简单氢化物中沸点最高的是M
A、该物质中存在离子键、极性共价键和非极性共价键 B、X、Y、M与Z均至少能形成两种化合物 C、Y的最简单氢化物与其最高价氧化物的水化物反应生成的化合物属于离子化合物 D、Y、Z、M对应的最简单氢化物中沸点最高的是M -
3、由下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
向某溶液中滴加几滴新制氯水,再滴加少量KSCN溶液,溶液变红
溶液中含有Fe2+
B
室温下,测得NaX和NaY溶液的pH分别为8和9
酸性:HX>HY
C
蔗糖溶液中加入少量稀硫酸,水浴加热5min,加氢氧化钠溶液至溶液呈碱性,再加入少量新制Cu(OH)2 , 继续加热5min,生成砖红色沉淀
蔗糖完全水解
D
向等体积等浓度的稀硫酸中分别加入少量等物质的量的ZnS和CuS固体,ZnS溶解而CuS不溶解
Ksp(ZnS)>Ksp(CuS)
A、A B、B C、C D、D -
4、硼碳氮(BCN)材料可用作耐磨涂层。下列说法正确的是( )A、原子半径: B、第一电离能: C、酸性强弱: D、硼、石墨、固态氮的晶体类型相同
-
5、设NA为阿伏加德罗常数的值。下列说法正确的是( )A、9.2g甲苯分子中含有碳碳双键的数目为0.3NA B、5.8g由NO和CO组成的混合气体中,原子总数为0.4NA C、标准状况下,22.4LO2与足量金属镁反应,转移的电子数为4NA D、0.1mol/L的CH3COONa溶液中CH3COO-和Na+的数目之和大于0.1NA
-
6、下列反应过程对应的离子方程式书写正确的是( )A、向NaClO溶液中通入过量SO2:SO2+ClO-+H2O=+HClO B、向氯化铝溶液中加入小苏打溶液:3+Al3+=Al(OH)3↓+3CO2↑ C、向NaHSO4溶液中加入NaHSO3溶液:+=+SO2↑+H2O D、向稀硝酸中加入FeCl2溶液:Fe2++2H++=Fe3++NO2↑+H2O
-
7、为克服传统的甲烷水蒸气重整制氢工艺中产生积碳和过多CO的缺点,科学家提出将传统的甲烷水蒸气重整分两步进行,即CH4催化裂解和催化剂消碳再生交替进行的循环制氢工艺(原理如图所示)。下列说法错误的是( )
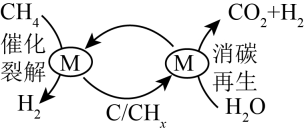 A、消碳再生过程涉及的反应之一为C+2H2OCO2+2H2 B、更换合适的催化剂,降低反应焓变,效果更好 C、每消耗1molCH4最多可产生4molH2 D、CHx为中间产物
A、消碳再生过程涉及的反应之一为C+2H2OCO2+2H2 B、更换合适的催化剂,降低反应焓变,效果更好 C、每消耗1molCH4最多可产生4molH2 D、CHx为中间产物 -
8、《本草述》冲记载了“芳草、山草”,其成分之一的结构简式如图。下列叙述错误的是( )
 A、该物质只含有三种官能团 B、该物质的分子式为C16H18O9 C、该物质能发生加成反应和取代反应 D、1mol该物质最多能消耗6molNa
A、该物质只含有三种官能团 B、该物质的分子式为C16H18O9 C、该物质能发生加成反应和取代反应 D、1mol该物质最多能消耗6molNa -
9、部分含氯物质的分类与相应化合价的关系如图所示。下列推理错误的是( )
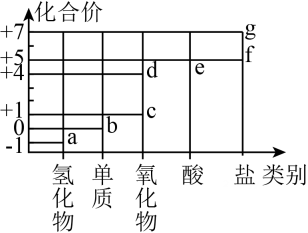 A、a与e反应可生成b B、d为酸性氧化物 C、c溶于水可生成HClO D、f、g中阴离子的VSEPR模型相同
A、a与e反应可生成b B、d为酸性氧化物 C、c溶于水可生成HClO D、f、g中阴离子的VSEPR模型相同 -
10、下列叙述正确的是( )。
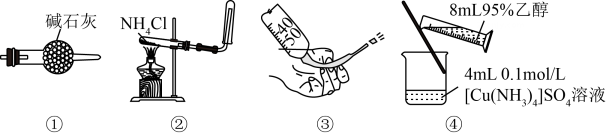 A、图①装置可用于干燥氯气 B、图②装置可用于制取氨气 C、图③操作可排出盛有溶液滴定管尖嘴内的气泡 D、图④装置可用于制备晶体
A、图①装置可用于干燥氯气 B、图②装置可用于制取氨气 C、图③操作可排出盛有溶液滴定管尖嘴内的气泡 D、图④装置可用于制备晶体 -
11、下列叙述正确的是( )。A、沸点: B、和的空间构型均为V形 C、分子中所有原子都满足8电子稳定结构 D、是含有极性键的非极性分子
-
12、与下列物质工业制法有关的反应不正确的是( )。A、工业制硫酸: B、工业制氯气:(浓) C、工业制硝酸: D、工业制铝:(熔融)
-
13、下列叙述正确的是( )。A、酸性: B、的电子式为 C、的原子结构示意图是
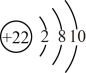 D、的空间构型是平面三角形
D、的空间构型是平面三角形
-
14、下列有关物质用途的叙述中,错误的是( )。A、醋酸既能除去水垢,也能除去铁锈 B、热的碳酸钠溶液可以洗去物品表面的柴油 C、穿久变黄的白衬衫用高锰酸钾溶液浸泡后,加入维生素C洗涤,可恢复白色 D、葡萄酒中添加少量二氧化硫可以起到杀菌的作用
-
15、基于生物质资源开发常见的化工原料,是绿色化学的重要研究方向.利用木质纤维素为起始原料结合生产聚碳酸对二甲苯酯可以实现碳减排,缓解日益紧张的能源危机,路线如下:
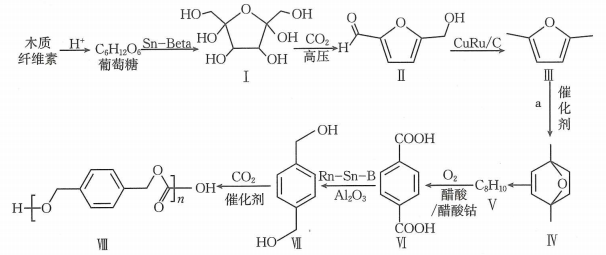
回答下列问题:
(1)、化合物Ⅰ的分子式为.(2)、分析化合物Ⅱ的结构,预测反应后形成的新物质,参考①的示例,完成下表.序号
变化的官能团的名称
可反应的试剂(物质)
反应后形成的新物质
反应类型
①

氧化反应
②
加成反应
(3)、化合物Ⅲ到化合物Ⅳ的反应是原子利用率100%的反应,且1molⅢ与1mol化合物a反应得到1mol Ⅳ,则化合物a为.(4)、已知化合物Ⅴ的核磁共振氢谱有2组峰,且峰面积之比为2:3,写出化合物Ⅴ的结构简式:.(5)、化合物Ⅶ的芳香族同分异构体中符合下列条件的有种(不含立体异构).①最多能与相同物质的量的反应;
②能与2倍物质的量的Na发生放出的反应.
(6)、关于Ⅶ生成Ⅷ的反应的说法中,不正确的有____.A、反应过程中,有H-O键断裂 B、反应过程中,有双键和C-O单键形成 C、该反应为缩聚反应 D、属于极性分子,分子中存在由p轨道“肩并肩”形成的键(7)、参照上述信息,写出以丙烯为起始有机原料合成 的路线(无机试剂任选).
的路线(无机试剂任选). -
16、2023年5月,中国神舟十六号载人飞船成功发射,三位航天员景海鹏、朱杨柱、桂海潮在天宫空间站开启长达半年的太空生活.(1)、法国化学家Paul Sabatier 提出并命名的“Sabatier反应”实现了甲烷化,科技人员基于该反应设计如图过程完成空间站中与的循环,从而实现的再生.

①写出与具有相同空间结构的一种微粒:.
②在特定温度下,由稳定态单质生成1mol化合物的焓变叫做该物质在此温度下的标准摩尔生成焓.表中为几种物质在298K的标准生成焓.
物质
标准摩尔生成焓
-393.51
-74.85
-241.82
0
则Sabatier反应.
③下列有关Sabatier反应说法正确的是.
A.输送进入Sabatier反应器的是电解水装置的阴极产物
B.采用高压和合适催化剂均有利于提高Sabatier反应的转化率
C.恒温条件下,在刚性容器中发生Sabatier反应,气体密度不变时,说明反应达到平衡
D.应该在Sabatier反应器的前端维持较高温度,后端维持较低温度
④一定条件下,分解形成碳的反应历程如图1所示,其中决定反应速率的是第步反应.

图1 图2
(2)、航天员呼吸产生的还可以利用Bosch反应:代替Sabatier反应.在250℃时,向体积为2L恒容密闭容器中通入和发生Bosch反应,测得容器内气压变化如图2所示.①试解释容器内气压先增大后减小的原因:.
②该温度下Bosch反应的(写出计算过程,为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压).
③在图2基础上画出其他条件相同,向体系加入催化剂时其压强随时间的变化曲线.
-
17、钕铁硼废料是一种具有较高经济价值的废弃物,主要成分为稀土元素钕(Nd)、Fe、B.一种采用分步沉淀从钕铁硼油泥中回收和的工艺流程如图:

已知:①200℃下氧化焙烧,钕铁硼废料中钕和铁主要以和的形式存在,硼常温下稳定,加热至300℃被氧化,不与稀酸反应.
②易与形成多种配合物离子,易与形成沉淀.
回答下列问题:
(1)、“预处理”是洗去钕铁硼表面的油污,可选择(填化学式)溶液.(2)、“滤渣1”的主要成分是(填名称).“浸出”时,盐酸浓度和固液比对钕、铁的浸出率影响如图所示,则浸出过程的最佳条件是. (3)、写出“沉钕”时生成沉淀的离子方程式:.(4)、“沉铁”时,加入铁粉的作用是.(5)、晶体结构片段如图所示.其中,的配位数为;碳原子采用杂化.现测定草酸亚铁晶体纯度.准确称取样品于锥形瓶,加入适量的稀硫酸,用溶液滴定至终点,消耗溶液.滴定反应:(未配平).该样品纯度为%.
(3)、写出“沉钕”时生成沉淀的离子方程式:.(4)、“沉铁”时,加入铁粉的作用是.(5)、晶体结构片段如图所示.其中,的配位数为;碳原子采用杂化.现测定草酸亚铁晶体纯度.准确称取样品于锥形瓶,加入适量的稀硫酸,用溶液滴定至终点,消耗溶液.滴定反应:(未配平).该样品纯度为%.
-
18、实验题.(1)、Ⅰ.配制溶液.
该实验需要用到的玻璃仪器有:烧杯、量筒、玻璃棒、、.(2)、为了防止水解,在配置过程中可以加入少量.(3)、Ⅱ.探究与Cu的反应.原理预测:
请写出与Cu的反应的离子方程式:.
(4)、开展实验并观察现象:某实验小组在进行与Cu的反应时观察到了异常现象,决定对其进行进一步的探究.
实验Ⅰ:

提出问题:
实验前,小组同学预测步骤2后溶液不会变为红色,原因是.
查阅文献:i.CuSCN为难溶于水的白色固体;
ii.被称为拟卤素离子,性质与卤素离子相似.
提出猜想:经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能.
猜测1:与KSCN发生了氧化还原反应.
猜测2:亚铁离子将其还原 , .
(5)、猜测1的离子方程式为.设计实验:
实验序号
对比实验及试剂
实验步骤
实验现象
II
A试管溶液
加入KSCN溶液
开始时溶液的上方变为红色,一段时间后红色向下蔓延,最后充满整支试管
B试管溶液
加入KSCN溶液
溶液变成绿色
II
C试管溶液
加入 , 溶液
溶液变为淡蓝色
再加KSCN溶液
溶液的上层变为红色,有白色沉淀产生,一段时间后整支试管溶液呈深红色
得出结论:
(6)、实验Ⅱ中试管(填字母)中的现象可以证实猜测1不成立.(7)、的氧化性本应强于 , 结合实验Ⅲ中的现象解释能正向发生的原因:. -
19、氢负离子具有强还原性,是一种颇具潜力的能量载体.2023年4月5日,我国科学家开发了首例室温全固态氢负离子二次电池,该电池通过固态氢负离子导体实现对的快速传导,其工作原理如图所示,其中放电时乙电极的电极反应式为(M为Li、Na、K、Mg、Ti等金属),下列说法错误的是( )
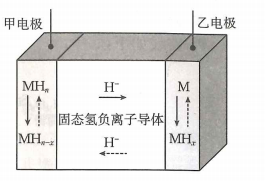 A、放电时,电子经外电路流向甲电极 B、放电时,氢负离子移向乙电极 C、充电时,甲电极发生的反应可表示为 D、可将固态离子导体替换成水溶液电解质,对氢负离子进行传导
A、放电时,电子经外电路流向甲电极 B、放电时,氢负离子移向乙电极 C、充电时,甲电极发生的反应可表示为 D、可将固态离子导体替换成水溶液电解质,对氢负离子进行传导 -
20、电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法.在化学计量点附近,被测离子浓度发生突跃,指示电极电位也产生了突跃,进而确定滴定终点.常温下,利用盐酸滴定某溶液中碳酸钠的含量,其电位滴定曲线与pH曲线如图所示(已知碳酸的电离常数 , ).下列说法正确的是( )
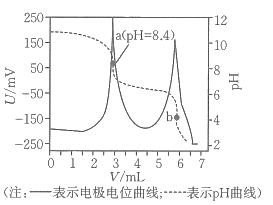 A、该滴定过程需要两种指示剂 B、a点溶液中存在: C、水的电离程度:a点<b点 D、a点溶液中
A、该滴定过程需要两种指示剂 B、a点溶液中存在: C、水的电离程度:a点<b点 D、a点溶液中