-
1、空气污染物NO通常用含的溶液吸收,生成 , 再利用电解法将上述吸收液中的转化为无毒物质 , 同时生成 , 其电解原理如图所示。下列说法不正确的是( )
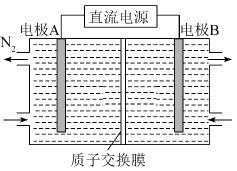 A、电极B为阳极,发生氧化反应 B、电极A上发生的电极反应: C、从电解槽右端上口流出,且可循环使用 D、若用阴离子交换膜代替质子交换膜,可提高电解效率,降低成本
A、电极B为阳极,发生氧化反应 B、电极A上发生的电极反应: C、从电解槽右端上口流出,且可循环使用 D、若用阴离子交换膜代替质子交换膜,可提高电解效率,降低成本 -
2、X、Y、Z、W是原子序数依次增大的短周期元素,X的2p轨道有两个未成对电子,Y元素原子半径在同周期中最大,X与Y最外层电子数之和与Z的最外层电子数相等,在地壳的岩层中存在元素W的游离态。下列说法正确的是( )A、第一电离能: , 电负性: B、Y、W形成的化合物中只存在离子键 C、X、Z、W的单质形成的晶体类型相同,均为分子晶体 D、X、W形成的一种离子呈平面三角形,则中心原子价层电子对数为3
-
3、Sharpless教授和Meldal教授因“点击化学”“生物正交化学”研究获2022年诺贝尔化学奖。“点击化学”就是用简单的小分子与生物大分子进行合成。类似的分子结构修饰在药物设计与合成中应用广泛。布洛芬具有抗炎、镇痛、解热作用,但口服该药对胃、肠道有刺激性,结构修饰过程如图所示。下列说法不正确的是( )
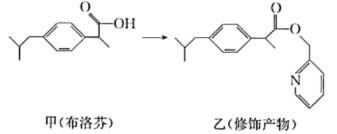 A、甲的分子式为 B、甲和乙都能与氢氧化钠溶液反应 C、甲分子中最多有8个碳原子共平面 D、乙可降低对胃、肠道的刺激
A、甲的分子式为 B、甲和乙都能与氢氧化钠溶液反应 C、甲分子中最多有8个碳原子共平面 D、乙可降低对胃、肠道的刺激 -
4、下列说法正确的是( )A、卤代烃、饱和一元醇都可发生消去反应,得到不饱和有机烯烃 B、酚醛树脂是最早合成的高分子材料,它由苯酚和甲醛加聚而成 C、味精谷氨酸钠最早从海带中提取,现主要通过纤维素发酵法生产 D、向蛋白质溶液中分别加入饱和硫酸钠溶液和硝酸银溶液都有固体析出
-
5、下列有关离子方程式书写正确的是( )A、硫酸铵和硫酸铁混合液与过量NaOH溶液混合: B、碳酸氢钙溶液与氢氧化钙溶液混合: C、苯酚钠溶液中通入少量气体:2
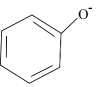 2
2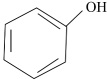 D、氯气通入70℃的浓氢氧化钠溶液中:
D、氯气通入70℃的浓氢氧化钠溶液中:
-
6、为阿伏加德罗常数的值,下列说法正确的是( )A、的NaClO溶液含有的数目小于 B、78g苯含有双键数目为3 , 单键数目为9 C、标准状况下,5.6LNO和混合后分子总数为0.5 D、含溶液中阳离子数目为0.4
-
7、下列说法不正确的是( )A、某溶液焰色试验为黄色,说明溶液中肯定含钠元素,可能含钾元素 B、重铬酸钾溶液中滴入某液体,颜色由橙变绿,说明液体中肯定含乙醇,可能含乙醛 C、可用紫外可见分光光度法测定废水中苯酚的含量 D、浓硝酸可检测蛋白质分子中是否含苯环结构
-
8、是HClO的酸性氧化物,具有强氧化性,加热易分解,可通过如下反应制取:。下列说法不正确的是( )A、还原产物是NaCl B、氧化剂与还原剂的物质的量之比为1:1 C、完全溶于水微热,会产生黄绿色气体 D、与还原剂接触或加热能发生剧烈反应,甚至爆炸
-
9、下列说法不正确的是( )A、工业上制备达98%的粗硅可直接用来生产卫星芯片 B、工业制备硫酸的主要设备为沸腾炉、接触室和吸收塔 C、硬度大的新型陶瓷材料碳化硅可用作砂纸的耐磨材料 D、某些胶态金属氧化物分散于玻璃中可制造有色玻璃
-
10、下列说法不正确的是( )A、二氧化硫、亚硫酸钠、苯甲酸钠都是食品中常用的脱氧剂 B、燕麦粉中添加微量、颗粒极细小铁粉,饮食后可暂时缓解缺铁性贫血 C、纯碱不仅是生产玻璃的原料,还可以去除玻璃表面的油污 D、硫酸钡不仅可以作白色颜料,还可用于医疗内服药剂“钡餐”
-
11、三水硫氰化亚铁可用作有机溶液中过氧化物的指示剂,其中S、C、N三原子没有形成大键。下列有关推断不正确的是( )A、电子式为
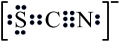 B、露置在空气中比更易氧化
C、配成溶液,加入过量过氧化氢,溶液最后显红色
D、还原性铁粉与HSCN溶液在隔绝空气条件下可制备硫氰化亚铁
B、露置在空气中比更易氧化
C、配成溶液,加入过量过氧化氢,溶液最后显红色
D、还原性铁粉与HSCN溶液在隔绝空气条件下可制备硫氰化亚铁
-
12、下列说法不正确的是( )A、科学家在盐碱地培育出优质水稻,稻米中含有的淀粉、蛋白质和脂肪都是高分子化合物 B、酶是一类由生物细胞产生的蛋白质或核酸,酶对生物体内的化学反应具有高效催化作用 C、寡糖中的十糖()不能被人体直接消化吸收,十糖可以作为糖尿病患者的甜味剂 D、氨基酸分子间能形成肽键,肽键中的氧原子与氢原子之间的氢键可形成蛋白质二级结构
-
13、化学与科学、社会、历史密切相关,下列叙述正确的是( )A、中国空间站核心舱有砷化镓半导体材料:位于周期表金属与非金属交界处 B、三星堆遗址出土大量铜器玉石,可通过断代法测玉石中含量来推测古蜀年代 C、明矾在一定条件下水解可生成胶体或浊液两种分散系,两种分散系互为同系物 D、螺环化合物(
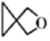 )可用于制造生物检测机器人,其二氯代物有4种(不考虑空间异构)
)可用于制造生物检测机器人,其二氯代物有4种(不考虑空间异构)
-
14、某些诗词中蕴含着丰富的化学知识,下列论述不正确的是( )A、“以曾青涂铁,铁赤色如铜”,涉及颜色变化和回收铜工艺 B、“东风扑酒香,吹醒殊乡愁”,涉及液体挥发并蕴涵酯化反应 C、“布衾(麻葛)多年冷似铁,娇儿恶卧踏里裂”,推测唐朝没有普及棉花种植 D、“五金(金银铜铁锡)元造化,九炼更精新”,自然界五金只能以化合态存在
-
15、下列仪器的名称不正确的是( )
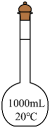
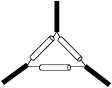

A容量瓶
B三脚架
C坩埚钳
D结晶皿
A、A B、B C、C D、D -
16、下列物质属于非电解质的是( )A、氯化镁 B、二氧化碳 C、碳酸氢钠 D、福尔马林
-
17、含有非极性键的离子化合物是( )A、 B、 C、 D、KOH
-
18、实验室以活性炭为催化剂,用CoCl2制取三氯化六氨合钴(Ⅲ){[Co(NH3)6]Cl3},装置如图所示。
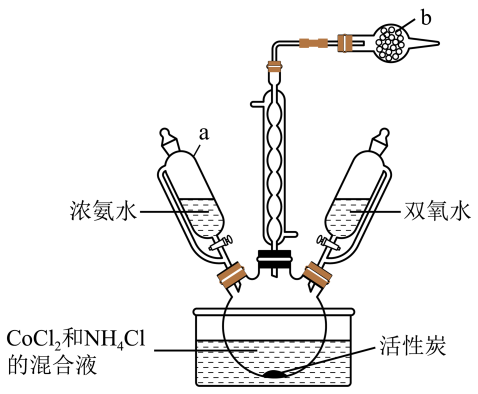
已知:
①[Co(NH3)6]2+具有较强还原性;溶液呈棕色
②。
回答下列问题:
(1)、仪器a使用恒压滴液漏斗的原因是;仪器b中的试剂是。(2)、产品制备:检查装置气密性并将CoCl2、NH4Cl和活性炭在三颈烧瓶中混合,滴加浓氨水,溶液变为棕色,NH4Cl的作用是;充分反应后缓慢滴加双氧水,水浴加热20min,该过程发生反应的离子方程式为。(3)、产品分离提纯:将反应后的混合物趁热过滤,待滤液冷却后加入适量浓盐酸,过滤、洗涤、干燥,得到[Co(NH3)6]Cl3晶体。该过程中趁热过滤的目的是。(4)、测定产品中NH3的含量。实验如下:①蒸氨:取0.5000g样品加入三颈烧瓶中,再加入足量NaOH溶液并加热,蒸出的NH3通入含有V1mL c1mol·L-1 H2SO4标准溶液的锥形瓶中。
②滴定:用c2mol·L-1 NaOH溶液滴定剩余的H2SO4 , 消耗V2mL NaOH溶液。滴定时选用的指示剂为 , NH3的质量分数为;
③误差分析:下列操作使得NH3的质量分数偏大的有。
A.用 H2SO4吸收NH3操作缓慢,导致部分NH3外溢到空气中
B.NaOH溶液使用前敞口放置于空气中一段时间
C.滴定后读数,先平视后俯视
D.滴定读数后,发现滴定管尖嘴处还悬有一滴氢氧化钠溶液
-
19、2020年9月22日,中国政府在联合国大会上提出:“二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。”为了早日实现碳中和,CO2的综合利用也成为了我国科研的研究热点。(1)、Ⅰ. 目前工业上有一种方法是用CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例、该过程分两步进行:
第一步: ΔH>0
第二步: ΔH<0
定义:在热力学标准状态下,由指定单质生成1mol化合物的反应焓称为该化合物的标准摩尔生成焓,简称生成焓,符号为。已知:;;。在热力学标准状态下,CO2加氢合成乙烯的热化学方程式为。(2)、有利于提高乙烯平衡产率的条件是____(填标号)。A、高温高压 B、低温高压 C、高温低压 D、低温低压(3)、已知上述两步反应的平衡常数与T的关系如图一所示,则第二步反应的平衡常数为(填“K1”或“K2”) (4)、Ⅱ. CO2加氢合成甲醇也是化学固碳的一种有效途径,不仅可以有效减少空气中的CO2排放,而且还能制备出甲醇清洁能源。反应如下:
(4)、Ⅱ. CO2加氢合成甲醇也是化学固碳的一种有效途径,不仅可以有效减少空气中的CO2排放,而且还能制备出甲醇清洁能源。反应如下:主反应: ΔH1=-49 kJ⋅mol-1
副反应: ΔH2=+41kJ⋅mol-1
向刚性容器中充入投料比为1:3的CO2和H2 , 图二中横坐标为在催化剂TiO2条件下反应相同的时间,CO2转化率随温度升高而升高。纵坐标为在该时间内CH3OH选择性和CO选择性(CH3OH的选择性、CO的选择性)随CO2转化率的变化。
图二中CO2的转化率是否为对应温度下的平衡转化率(填“是”或“否”或“不一定”)。 (5)、若图二中CO2的转化率为对应温度下的平衡转化率,则CH3OH选择性降低的原因是。(6)、若图二中M点时[初始投料n(CO2)=1mol,n(H2)=3mol,容器体积为1L],整个体系已经达到平衡,此时CO2的转化率为50%,CH3OH的选择性为15%,则氢气的转化率α(H2)= (计算结果保留一位小数)。(7)、已知速率方程v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2O),k正、k逆是速率常数,只受温度影响,其对数lgk与温度的关系如图三所示,直线(填“A”或“B”)表示的是lgk正与温度的关系。
(5)、若图二中CO2的转化率为对应温度下的平衡转化率,则CH3OH选择性降低的原因是。(6)、若图二中M点时[初始投料n(CO2)=1mol,n(H2)=3mol,容器体积为1L],整个体系已经达到平衡,此时CO2的转化率为50%,CH3OH的选择性为15%,则氢气的转化率α(H2)= (计算结果保留一位小数)。(7)、已知速率方程v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2O),k正、k逆是速率常数,只受温度影响,其对数lgk与温度的关系如图三所示,直线(填“A”或“B”)表示的是lgk正与温度的关系。
-
20、已知:锂钴电池总反应:。过程如图:
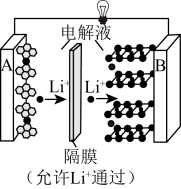 (1)、中,Co元素的化合价为。锂电池发生火灾时,和氧气发生反应的主要物质是(填“正”或“负”)极材料。充电时阳极的反应方程式是。(2)、锂电池成本高昂,废弃后需回收其中的锂和钴元素。先将上述锂电池进行放电处理,拆卸后,再将正极材料涂覆在铝箔上,进行电解,浸出和。装置如图所示,该条件下副反应忽略不计。
(1)、中,Co元素的化合价为。锂电池发生火灾时,和氧气发生反应的主要物质是(填“正”或“负”)极材料。充电时阳极的反应方程式是。(2)、锂电池成本高昂,废弃后需回收其中的锂和钴元素。先将上述锂电池进行放电处理,拆卸后,再将正极材料涂覆在铝箔上,进行电解,浸出和。装置如图所示,该条件下副反应忽略不计。
①拆卸前,将锂电池放电处理有利于锂在正极的回收,其原因是。
②石墨电极连接电源的极(填“正”或“负”)。
③结合电极反应,指出阴极室的pH变化并解释原因:。
(3)、当前,三元正极材料——镍钴锰酸锂应用广泛,其化学式可写作。可用、、、与空气混合加热烧结制得。写出制备的化学方程式:(设的计量系数为1)。