-
1、铁铝矾有净水作用,将其溶于水中得到浅绿色溶液,有关该溶液的叙述正确的是( )A、该溶液显中性 B、该溶液中: C、在空气中蒸干并灼烧该溶液,最后所得的残留固体为 D、向该溶液中加入溶液,当完全沉淀时,恰好被完全沉淀
-
2、下列关于的说法错误的是( )A、中铁元素有价和价,是混合物 B、配制溶液时,先将晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 C、溶于一定量稀硝酸中可能生成和Fe2+ D、向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化
-
3、常温下,下列各组离子在指定溶液中能大量共存的是( )A、无色透明的溶液中: B、的溶液中: C、的溶液中: D、能使甲基橙变红的溶液中:
-
4、科研小组用氧化—沉淀法从废电池浸出液中去除铁:用氧化废电池浸出液中的(酸性条件下,被还原为),再加适量溶液调使转化为沉淀.研究发现对氧化率和铁去除率的影响如图1和图2所示。
图1

图2

下列说法错误的是( )
A、由图1可推断的氧化性随浸出液增大而减弱 B、若起始浸出液与反应一段时间后,浸出液会减小 C、转变为沉淀的离子方程式为 D、推测若用溶液调也可以使转化为沉淀 -
5、根据实验操作及现象,下列结论正确的是( )
选项
实验操作及现象
结论
A
向溶液中滴加溶液,生成的白色沉淀迅速变成灰绿色,过一段时间后变为红褐色
有还原性
B
向某溶液中滴加溶液,产生白色沉淀
原溶液中一定含有Cl-
C
向某溶液中滴加酸性KMnO4溶液,紫色褪去
原溶液中一定含有
D
向某溶液中加入盐酸产生无色气体,该气体能使澄清石灰水变浑浊
原溶液中一定含有
A、A B、B C、C D、D -
6、室温下,下列各组离子在指定溶液中能大量共存的是( )A、溶液中: B、酸性溶液中: C、澄清透明的溶液中: D、使酚酞变红色的溶液中:
-
7、下列物质中属于碱性氧化物的是( )A、CO2 B、 C、 D、
-
8、一定量通入500mL某浓度的NaOH溶液中得到溶液A,向溶液A中逐滴滴入稀盐酸,加入与生成的关系如图所示。下列有关叙述错误的是( )
 A、XY段发生反应的离子方程式为 B、原溶液中 C、通入的
A、XY段发生反应的离子方程式为 B、原溶液中 C、通入的 气体体积为44.8L
D、溶液A中含和
气体体积为44.8L
D、溶液A中含和 各1 mol
各1 mol
-
9、下列反应的离子方程式中,书写正确的是( )A、铁粉与稀硫酸反应: B、钠与水反应: C、鸡蛋壳(主要成分为) 醋酸反应: D、小苏打与盐酸反应:
-
10、下列关于铝的叙述不正确的是( )A、铝是地壳中含量最多的金属元素 B、在化学反应中,铝容易失去电子,作氧化剂 C、在常温下,铝能与NaOH溶液反应 D、铝是一种比较活泼的金属
-
11、有关的叙述不正确的是( )A、是淡黄色固体 B、可以作供氧剂 C、应密封保存 D、氧元素的化合价为-2价
-
12、实验室由安息香制备二苯乙二酮的反应式如图:

相关信息列表如表:
物质
性状
熔点/℃
沸点/℃
溶解性
安息香
白色固体
133
344
难溶于冷水溶于热水、乙醇、乙酸
二苯乙二酮
淡黄色固体
95
347
不溶于水溶于乙醇、苯、乙酸
冰乙酸
无色液体
17
118.
与水、乙醇互溶
装置示意图如图所示,实验步骤为:
部溶解。①在圆底烧瓶中加入10mL冰乙酸、5mL水及9.0g , 边搅拌边加热,至固体全
②停止加热,待沸腾平息后加入2.0g安息香,加热回流45~60min。
③加入50mL水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6g。

回答下列问题:
(1)、实验中加热方式采用油作为热传导介质,该加热方法的优点是。(2)、仪器B的名称是;冷却水应从(填“a”或“b”)口通入。(3)、实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是。(4)、在本实验中,为氧化剂且过量,其还原产物为;某同学尝试改进本实验:采用催化量的并通入空气制备二苯乙二酮。该方案是否可行(填“是”或“否”),简述判断理由。(5)、本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是。(6)、若粗品中混有少量未氧化的安息香,可用少量洗涤的方法除去 (填标号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯。a.热水
b.乙酸
c.冷水
d.乙醇
(7)、本实验的产率最接近于(填标号)。a.85%
b.80%
c.75%
d.70%
-
13、海水资源开发利用的部分过程如图所示。
 (1)、向苦卤中通入制备溴的离子方程式为:。(2)、从制取金属 , 工业上常用方法。(3)、粗盐中含的杂质离子有、、 , 提纯过程中加入试剂的顺序不正确是。
(1)、向苦卤中通入制备溴的离子方程式为:。(2)、从制取金属 , 工业上常用方法。(3)、粗盐中含的杂质离子有、、 , 提纯过程中加入试剂的顺序不正确是。A.、、、盐酸
B.、、、盐酸C.、、、盐酸
D.、、盐酸实验过程中,请简述验证溶液中的已沉淀完全的简单操作及现象是。
(4)、加入盐酸的目的是。(5)、从除杂后的氯化钠溶液中获得固体需要的仪器有铁架台(带铁圈)、酒精灯和。 -
14、某工厂排放的工业废水中含Fe3+ , Al3+ , Cu2+ ,工厂为了减少环境污染,利用废铁屑和其他化学试剂进行如图操作,得到了铁红、Al2O3和金属Cu,回答下列问题:
 (1)、固体A的成分是。(用化学式表示)(2)、写出B→D的离子方程式。要检验溶液D中是否含有所需的试剂是(用化学式表示)溶液,若含有
(1)、固体A的成分是。(用化学式表示)(2)、写出B→D的离子方程式。要检验溶液D中是否含有所需的试剂是(用化学式表示)溶液,若含有 则观察到的现象是。 (3)、溶液E焰色反应呈黄色,试剂H是(用化学式表示);D→E反应的离子方程式是。(4)、写出铁红在工业上的一种主要用途:。
则观察到的现象是。 (3)、溶液E焰色反应呈黄色,试剂H是(用化学式表示);D→E反应的离子方程式是。(4)、写出铁红在工业上的一种主要用途:。 -
15、有机物X是一种药物合成的中间体,其结构简式为
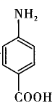 。X的一种合成路线如图所示(分离方法和其他产物略)。
。X的一种合成路线如图所示(分离方法和其他产物略)。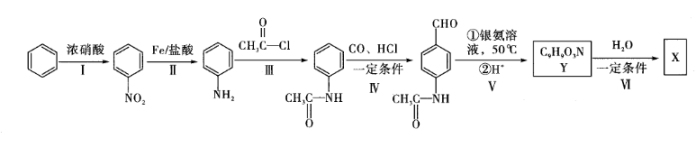 (1)、下列关于有机物X的说法错误的是____(填标号)。A、属于芳香族化合物 B、分子中所有原子一定在同一平面 C、核磁共振氢谱有4组峰,且峰面积之比为2:2:2:1 D、既能与盐酸反应又能与氢氧化钠溶液反应(2)、步骤Ⅰ的反应条件是 , 步骤Ⅱ的反应类型是。(3)、步骤Ⅲ和Ⅵ在合成有机物X过程中的目的是。(4)、步骤Ⅴ的第①步反应的化学方程式为。(5)、Z是有机物Y的同分异构体,且满足三个条件:①含有—CONH2;②能与NaHCO3溶液反应产生CO2;③苯环上的一氯取代产物有两种。则Z的结构简式为。
(1)、下列关于有机物X的说法错误的是____(填标号)。A、属于芳香族化合物 B、分子中所有原子一定在同一平面 C、核磁共振氢谱有4组峰,且峰面积之比为2:2:2:1 D、既能与盐酸反应又能与氢氧化钠溶液反应(2)、步骤Ⅰ的反应条件是 , 步骤Ⅱ的反应类型是。(3)、步骤Ⅲ和Ⅵ在合成有机物X过程中的目的是。(4)、步骤Ⅴ的第①步反应的化学方程式为。(5)、Z是有机物Y的同分异构体,且满足三个条件:①含有—CONH2;②能与NaHCO3溶液反应产生CO2;③苯环上的一氯取代产物有两种。则Z的结构简式为。 -
16、锂是最轻的活泼金属,其单质及其化合物有广泛的用途。
回答下列问题:
(1)、在元素周期表中,与的化学性质最相似的邻族元素是 , 该元素基态原子中,占据最高能级电子的电子云轮廓图形状为。(2)、是一种储氢材料。①与中第一电离能较小的元素是。
②离子半径:(填“>”“=”或“<”)。
(3)、已知金属锂晶体为FCC(面心立方晶格),面心立方紧密堆积结构示意图如下:
①晶胞中锂的配位数为。
②若锂原子的半径为 , 阿伏加德罗常数的值为 , 则锂晶体密度为(列出含有a、的计算式即可)。
-
17、检验的反应有如下两种途径。下列说法正确的是( )
 A、反应①中被还原 B、乙醚与中的铬元素形成共价键,有利于蓝色现象的观察 C、反应②为: D、反应③中溶液pH越小,反应速率越慢
A、反应①中被还原 B、乙醚与中的铬元素形成共价键,有利于蓝色现象的观察 C、反应②为: D、反应③中溶液pH越小,反应速率越慢 -
18、氮氧化物是大气污染物之一,如图为科研人员探究消除氮氧化物的反应机理,下列说法不正确的是( )
 A、过程I中NO既作氧化剂又作还原剂 B、过程Ⅱ中每生成1mol时,转移电子的数目约为4×6.02×1023 C、过程中涉及的反应均为氧化还原反应 D、整个过程中+作催化剂
A、过程I中NO既作氧化剂又作还原剂 B、过程Ⅱ中每生成1mol时,转移电子的数目约为4×6.02×1023 C、过程中涉及的反应均为氧化还原反应 D、整个过程中+作催化剂 -
19、乙炔水化法、乙烯氧化法是工业上制备乙醛的两个重要方法,反应原理分别为:。以下叙述不正确的是( )A、的电子式为 B、根据价层电子互斥模型,18g水的中心原子含有2mol孤电子对 C、乙烯氧化法中,生成0.1mol乙醛时,转移的电子数约为 D、标准状况下,11.2L中含有π键的数目约为
-
20、已知反应:。取等量 , 分别在和下,测得其转化率随时间变化的关系曲线(曲线)如图所示。下列说法错误的是( )
 A、曲线a代表下的曲线 B、内,的平均反应速率 C、升高温度,可缩短反应达到平衡的时间,并能增大的平衡转化率 D、从到 , 的产量
A、曲线a代表下的曲线 B、内,的平均反应速率 C、升高温度,可缩短反应达到平衡的时间,并能增大的平衡转化率 D、从到 , 的产量