-
1、为实现我国承诺的“碳达峰、碳中和”目标,中国科学院提出了“液态阳光”方案,即将工业生产过程中排放的二氧化碳转化为甲醇,其中反应之一是: 。回答下列问题:(1)、该反应的能量变化如图所示,反应的 , 曲线(填“a”或“b”)表示使用了催化剂。
 (2)、下列措施既能加快反应速率,又能提高CO转化率的是____;A、升高温度 B、增大压强 C、降低温度 D、增加投料量(3)、相同温度下,若已知:
(2)、下列措施既能加快反应速率,又能提高CO转化率的是____;A、升高温度 B、增大压强 C、降低温度 D、增加投料量(3)、相同温度下,若已知:①反应的平衡常数为;
②反应的平衡常数为;
则:反应的化学平衡常数(用含和的代数式表示)。
(4)、在恒温恒容密闭容器中按加入反应起始物Ⅰ.下列描述不能说明反应达到平衡状态的是。
A.容器内压强不再变化 B.氢气的转化率达到最大值
C.容器内CO与的浓度相等 D.容器内CO的体积分数不再变化
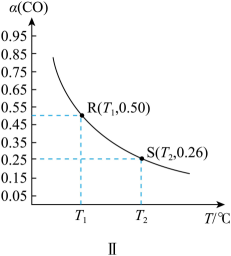
Ⅱ.若CO的平衡转化率[]随温度的变化曲线如图Ⅱ所示,R、S两点平衡常数大小:(填“>”、“=”或“<”)。温度下,测得起始压强 , 达平衡时。
-
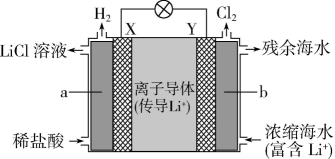
2、电池的种类繁多,应用广泛。根据电化学原理回答下列问题。(1)、电池是一种能被海水激活的一次性贮备电池,电池总反应为 , 则负极材料为 , 正极反应式为。(2)、浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。X极生成时,移向(填“X”或“Y”)极。
 (3)、微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用如图装置处理有机废水(以含的溶液为例)。隔膜1为(填“阴”或“阳”)离子交换膜,负极的电极反应式为 , 当电路中转移0.2mol电子时,模拟海水理论上除盐g。
(3)、微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用如图装置处理有机废水(以含的溶液为例)。隔膜1为(填“阴”或“阳”)离子交换膜,负极的电极反应式为 , 当电路中转移0.2mol电子时,模拟海水理论上除盐g。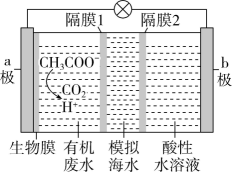
-
3、某市对大气进行监测,发现该市首要污染物为可吸入颗粒物(直径小于等于的悬浮颗粒物),其主要来源为燃煤、机动车尾气等因此,对、、等进行研究具有重要意义。
请回答下列问题:
(1)、为减少的排放,常采取的措施如下:将煤转化为清洁气体燃料。已知: ;
。
写出焦炭与水蒸气反应的热化学方程式:。
(2)、汽车尾气的转化:①NO在催化条件下分解,反应在恒温密闭容器中下进行: ;某温度下,NO平衡转化率为10.0%,该温度下的平衡常数为 , 若某时刻、、分别为2.0mol、1.0mol、0.50mol,此时反应(填序号)。
a.向逆反应方向进行
b.向正反应方向进行
c.达到平衡状态
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:。已知该反应的 , 简述该设想能否实现的依据:。
(3)、清洁能源具有广阔的开发和应用前景,可减小污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池,一定条件下用CO和合成: 。向体积为2L的密闭容器中充入2molCO和 , 测得不同条件下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
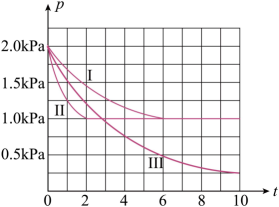
①Ⅱ和Ⅰ相比,改变的反应条件是;
②若反应Ⅰ的温度(),反应Ⅲ的温度(),则(填“小于”、“大于”或“等于”),简要说明判断依据:。
-
4、执法交警最常用的一种酒精检测仪的工作原理示意图如图所示,其反应原理为: , 被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是( )
 A、呼出气体中酒精含量越高,微处理器中通过的电流越小 B、电解质溶液中的移向a电极 C、b为正极,电极反应式为 D、a极上的电极反应式为
A、呼出气体中酒精含量越高,微处理器中通过的电流越小 B、电解质溶液中的移向a电极 C、b为正极,电极反应式为 D、a极上的电极反应式为 -
5、在容积固定为1.00L的密闭容器中,通入一定量的 , 发生反应 , 100℃时体系中各物质的浓度随时间变化如图所示。下列说法正确的是( )
 A、时刻反应已经达到平衡状态 B、100℃时,反应的平衡常数K为0.36 C、待容器中混合气体的密度不变时,说明反应达到平衡状态 D、100℃时,在0~60s时段反应的平均反应速率
A、时刻反应已经达到平衡状态 B、100℃时,反应的平衡常数K为0.36 C、待容器中混合气体的密度不变时,说明反应达到平衡状态 D、100℃时,在0~60s时段反应的平均反应速率 -
6、某种碱性氢氧燃料电池的的正极反应式为:。下列有关该电池的叙述正确的是( )A、负极上发生的反应为 B、工作时,电解质溶液中的向正极移动 C、工作一段时间后,电解液中KOH的物质的量浓度减小 D、若电池在工作过程中有0.4mol电子转移,则正极消耗
-
7、下列对于化学反应方向说法正确的是( )A、一定温度下,反应的 , B、反应 , 则该反应在低温下能自发进行 C、常温下反应能自发进行,则 D、反应在一定条件下能自发进行,则该反应的合金
-
8、科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用CuSi合金作硅源,在950℃利用三层液熔盐进行电解精炼,下列说法正确的是( )
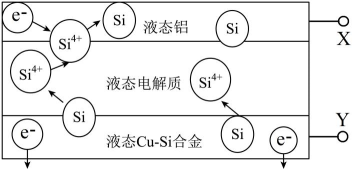 A、X与电源的正极相连 B、电子由液态CuSi合金流出 C、电子能够在三层液熔盐间自由流动 D、在该液相熔体中Cu优先于Si被氧化,优先于被还原
A、X与电源的正极相连 B、电子由液态CuSi合金流出 C、电子能够在三层液熔盐间自由流动 D、在该液相熔体中Cu优先于Si被氧化,优先于被还原 -
9、在密闭容器中的一定量混合气体发生反应: , 平衡时测得C的浓度为0.50mol/L。保持温度不变,将容器的容积压缩到原来的一半,再达到平衡时,测得C的浓度变为0.90mol/L。下列有关判断不正确的是( )A、B的体积分数增大了 B、A的转化率降低了 C、平衡向正反应方向移动 D、
-
10、反应 达平衡状态后,改变某一条件,下列图像与条件变化一致的是( )A、升高温度
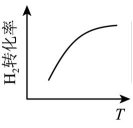 B、增大浓度
B、增大浓度 C、改变压强
C、改变压强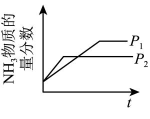 D、加入催化剂
D、加入催化剂
-
11、利用如图所示装置(电极均为惰性电极)可吸收 , 并用阴极排出的溶液吸收。下列说法正确的是( )
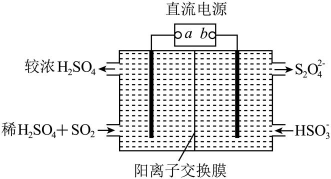 A、b为直流电源的正极 B、将装置中的阳离子交换膜换成阴离子交换膜电极反应式不变 C、电解时,由阴极室通过阳离子交换膜到阳极室 D、阳极的电极反应式为
A、b为直流电源的正极 B、将装置中的阳离子交换膜换成阴离子交换膜电极反应式不变 C、电解时,由阴极室通过阳离子交换膜到阳极室 D、阳极的电极反应式为 -
12、参照反应的能量随反应历程变化的示意图,下列叙述中正确的是( )
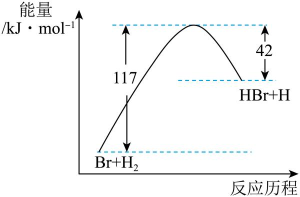 A、正反应为吸热反应 B、该反应的 C、反应物具有的总能量大于生成物具有的总能量 D、图中可以看出,HBr的能量一定高于的能量
A、正反应为吸热反应 B、该反应的 C、反应物具有的总能量大于生成物具有的总能量 D、图中可以看出,HBr的能量一定高于的能量 -
13、下列不能用勒夏特列原理解释的是( )A、、、HI组成的平衡体系加压后颜色变深 B、红棕色的加压后颜色先变深后变浅 C、合成氨工业中使用高压以提高氨的产量 D、黄绿色的氯水光照后颜色变浅
-
14、工业上制取浓硝酸涉及下列反应:
②
①
③
下列有关工业制取浓硝酸反应的说法不正确的是( )
A、反应①达到平衡时 B、使用高效催化剂能提高反应①中NO的平衡转化率 C、反应②在一定温度下能自发进行,则正反应为放热反应 D、标准状况下,反应③中每消耗 , 转移电子的数目约为 -
15、Ni可活化制得 , 其反应历程如图所示:
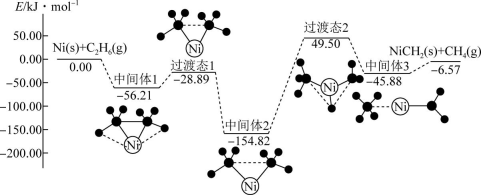
下列关于活化历程的说法正确的是( )
A、总反应的 B、Ni是该反应的催化剂,参与反应的过程 C、总反应的速率由“中间体2→中间体3”决定 D、该反应过程中分别有碳氢键、碳碳键的断裂和形成 -
16、下列叙述正确的是( )A、的燃烧热 , 则反应的 B、HCl和NaOH反应的中和热为 , 则和反应的中和热为 C、用等体积的盐酸、溶液进行中和热测定的实验,会使测得的中和热偏大 D、一定条件下,将和置于密闭容器中充分反应生成放热19.3kJ,其热化学方程式为
-
17、研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述错误的是( )A、加快了反应的速率 B、降低了反应的活化能 C、改变了反应的历程 D、增大了反应的平衡常数
-
18、我国是稀土储量大国,氧化铈(CeO2)是一种应用广泛的稀土氧化物。一种用氟碳铈矿(CeFCO3 , 含BaO、SiO2等杂质)为原料制备CeO2的工艺如下图。
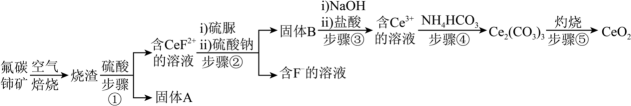
已知:①Ce3+可形成难溶于水的复盐[(Ce2(SO4)3·Na2SO4·nH2O],其氢氧化物也难溶于水。
②硫脲的结构简式为CS(NH2)2 , 在酸条件下易被氧化为(CSN2H3)2。
请回答:
 (1)、实验室常用下图所示仪器进行固体物质的粉碎,该仪器的名称是。步骤①和步骤②均有操作(填操作名称)(2)、焙烧后加入稀硫酸浸出,Ce元素的浸出率和稀硫酸浓度、温度的关系如图所示,下列说法正确的是
(1)、实验室常用下图所示仪器进行固体物质的粉碎,该仪器的名称是。步骤①和步骤②均有操作(填操作名称)(2)、焙烧后加入稀硫酸浸出,Ce元素的浸出率和稀硫酸浓度、温度的关系如图所示,下列说法正确的是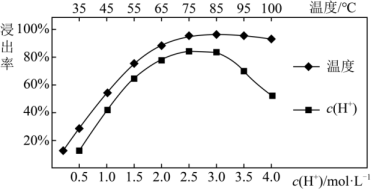
A.固体A的成分是SiO2
B.步骤②加入硫脲的目的将还原为
C.根据上图,焙烧后加入稀硫酸浸出时,适宜的条件为85℃,c(H2SO4)=2.5mol/L(3)、步骤④发生的离子方程式为。(4)、取ag所制CeO2 , 溶解后配制成250mL溶液。取bmL该溶液用0.01mol·L-1(NH4)2Fe(SO4)2溶液滴定,滴定时发生反应:Fe2++Ce4+=Fe3++Ce3+ , 达到滴定终点时消耗(NH4)2Fe(SO4)2溶液VmL。滴定过程中,接近终点时需采用半滴操作,具体操作是:慢慢旋转滴定管旋塞,使滴定管口悬挂液滴而不滴落,用靠落液滴,并用将液滴冲入溶液中,振荡锥形瓶使溶液充分混合。
(5)、该产品中CeO2的质量分数为 (列出表达式)(6)、与铈同为过度金属的Fe元素在自然界中形成黄铁矿(主要成分FeS2),FeS2晶体的晶胞结构如图4所示。在晶胞中,Fe2+位于所形成的(填“正四面体”或“正八面体”)空隙;若晶胞参数为anm,密度为ρg•cm−3 , 阿伏加德罗常数的值为NA , 则FeS2的摩尔质量M=g⋅mol-1(用含a、ρ、NA的代数式表示)。
-
19、有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:(1)、岩脑砂的制备:

①利用装置A制取实验所需的氨气,写出反应的化学方程式:。
②该实验中用浓盐酸与MnO2反应制取所需氯气,装置B中盛放浓盐酸的仪器名称是 , 写出该反应的离子方程式:。则装置E中用于除气体杂质的试剂是(填写试剂名称)
③为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序
a→d→c→→ ←j←i←h←g←b
④证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要 、 等两种;岩脑砂的主要成分中所含化学键的类型、、
(2)、氨气和氯气反应制取岩脑砂时同时生成N2。氨气和氯气反应生成N2的化学方程式是。
(3)、和氮元素同主族的砷存在多种同素异形体——黄砷、黑砷、灰砷①黄砷结构与白磷相似,黄砷的空间构型为 , 第三周期,第一电离能介于Al和P之间的元素有种。
②近年来,黑砷在催化电解水方面的研究受到关注,其晶体结构与石墨类似。根据图中信息,下列说法正确的有(填标号)。

a.黑砷中As—As键的键能均相同
b.黑砷与C60都属于混合型晶体
c.黑砷单层中As原子与As—As键的个数比为2:3
d.黑砷层与层之间的作用力为范德华力
-
20、X、W、Y、Z、M、Q、R、L是元素周期表前四周期元素,且原子序数依次增大,其相关信息如表:
元素
相关信息
X
原子核外有6种不同运动状态的电子
Y
基态原子中s电子总数与p电子总数相等
Z
原子半径在同周期元素中最大
M
逐级电离能(kJ•mol-1)依次为578、1817、2745、11575、14830、18376
Q
基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反
R
基态原子核外有7个能级且能量最高的能级上有6个电子
L
基态原子核外有四个电子层,最外层只有一个电子,其它电子层均排满电子
请用化学用语填空:
(1)、X元素在元素周期表的位置:。(2)、请写出Q元素基态原子核外电子排布式:。(3)、X、Y、Z、M四种元素的原子半径由小到大的顺序是(用元素符号表示)。(4)、R元素可形成R2+和R3+ , 其中较稳定的是R3+ , 原因是。(5)、与M元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物的水化物反应的化学方程式:;M、Z晶体都是由金属原子密置层在三维空间堆积而成(最密堆积),M的熔点(930K)比Z的熔点(371K)高,原因是;已知T元素和Q元素的电负性分别为1.5和3.0,则它们形成的化合物是(填“离子化合物”或“共价化合物”)。(6)、硒(Se)是人体必需的微量元素,与Y为同一主族元素,Se原子比Y原子多两个电子层,则Se的原子序数为 , 其最高价氧化物对应的水化物化学式为。(7)、X射线衍射法可以测定某些分子结构,NH3分子结构为;其电子式为 , 中心原子的杂化类型(8)、L的基态原子价电子轨道表示式为;在周期表中该原子排在区(9)、水在液态时,几个水分子可以形成缔合水分子(H2O)n的原因是水分子之间存在 。(10)、三氟乙酸乙酯是制备某种抗新冠病毒药物的原料,合成该分子所需的原料三氟乙酸的酸性乙酸的酸性(填“大于”或“小于”),请理论解释原因