-
1、氮氧化物会对生态系统和人体健康造成危害。一种以沸石笼作为载体对氮氧化物进行催化还原的原理如图所示。下列叙述不正确的是( )
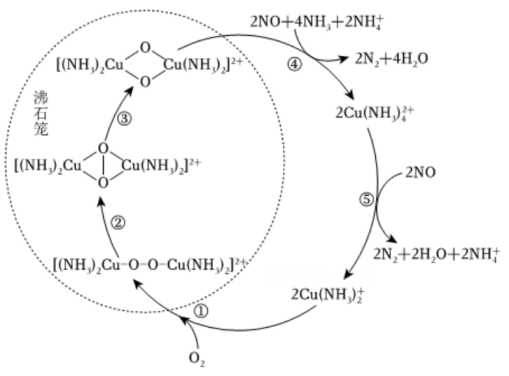 A、反应⑤变化过程可表示为: B、图中总过程中每吸收需要标准状况下的氧气为 C、反应③未涉及元素化合价的变化 D、反应④涉及非极性共价键的断裂与生成
A、反应⑤变化过程可表示为: B、图中总过程中每吸收需要标准状况下的氧气为 C、反应③未涉及元素化合价的变化 D、反应④涉及非极性共价键的断裂与生成 -
2、实验室模拟工业处理含铬废水,操作及现象如图1所示,反应过程中铬元素的化合价变化如图2,已知:深蓝色溶液中生成了CrO5。下列说法不正确的是( )
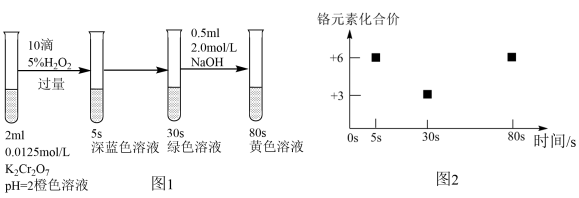 A、0-5 s过程中,发生的氧化还原反应为: B、实验开始至30 s溶液中发生的总反应离子方程式为: C、30-80 s过程中,Cr元素被氧化,可能是溶液中剩余的H2O2所致 D、80 s时,在碱性条件下,溶液中含铬微粒主要为
A、0-5 s过程中,发生的氧化还原反应为: B、实验开始至30 s溶液中发生的总反应离子方程式为: C、30-80 s过程中,Cr元素被氧化,可能是溶液中剩余的H2O2所致 D、80 s时,在碱性条件下,溶液中含铬微粒主要为 -
3、工业上制备下列物质的生产流程合理的是( )A、由铝土矿冶炼铝:铝土矿Al2O3AlCl3Al B、由NaCl制漂白粉:饱和食盐水Cl2漂白粉 C、由石英砂制纯硅:石英砂粗硅SiHCl3纯硅 D、工业合成硝酸:N2NONO2HNO3
-
4、下列图示的实验,能够实现相应实验目的的是( )
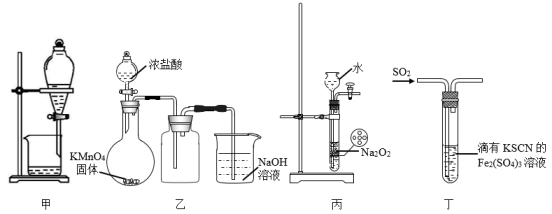 A、利用甲装置用CCl4从碘水中萃取碘 B、利用乙装置制取并收集少量纯净的氯气 C、利用丙装置控制制取氧气的速率 D、利用丁装置验证SO2的漂白性
A、利用甲装置用CCl4从碘水中萃取碘 B、利用乙装置制取并收集少量纯净的氯气 C、利用丙装置控制制取氧气的速率 D、利用丁装置验证SO2的漂白性 -
5、部分含氮、硫元素的化合物的“价—类”二维图如图所示。下列关于各物质的说法错误的是( )
 A、i在一定条件下均可以与a、b、c发生反应 B、e的浓溶液可用于干燥c、f、g C、g与在汽车催化转化器中会转化成两种无毒气体 D、h排放到空气中可形成酸雨
A、i在一定条件下均可以与a、b、c发生反应 B、e的浓溶液可用于干燥c、f、g C、g与在汽车催化转化器中会转化成两种无毒气体 D、h排放到空气中可形成酸雨 -
6、下列物质的应用中,与氧化还原反应无关的是( )A、用含Fe2O3的铁矿石冶炼Fe B、用Na2O2作潜水艇的供氧剂 C、用NaOH作沉淀剂去除粗盐水中的Mg2+ D、以NH3为原料制备HNO3
-
7、下列说法正确的是( )A、将足量NH3、CO2依次通入饱和食盐水中,无白色沉淀生成 B、将KSCN溶液滴入盐酸和Fe(NO3)2的混合溶液中,溶液显红色 C、将饱和FeCl3溶液滴入NaOH溶液中,可制得Fe(OH)3胶体 D、将盐酸酸化
 BaCl2溶液滴入某溶液中产生白色沉淀,证明该溶液中一定含有SO
BaCl2溶液滴入某溶液中产生白色沉淀,证明该溶液中一定含有SO
-
8、下列说法正确的是( )A、标准状况下,22.4 L Br2所含溴原子的数目为2 NA B、等质量的NO2和N2O4所含原子总数不同 C、136 g熔融的KHSO4中含有2 NA个阳离子 D、标准状况下,22.4 L CO2与足量Na2O2反应转移的电子数为NA
-
9、下列反应的离子方程式正确的是( )A、向硝酸银溶液中加入足量铜:Cu+Ag+=Ag+Cu2+ B、用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+=I2+2H2O C、等体积、等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:2HCO+Ba2++2OH-=BaCO3↓+2H2O+CO D、向硫酸铜溶液中加入过量氨水:Cu2++2NH3·H2O =Cu(OH)2↓+2NH
-
10、常温下,在指定溶液中下列各组离子可能大量共存的是( )A、滴加KSCN显红色的溶液: 、Cl-、K+、 B、K2S溶液中: 、K+、Cl-、Cu2+ C、由水电离出的c(OH-)=10-12 mol/L的溶液:Al3+、H+、Cl-、Na+ D、强酸性溶液中: Cl-、Na+、、
-
11、科学家研究出了一种如下图的 “纳米药物分子运输车”,它可装载药物直达病灶,大大提高了肿瘤的治疗效果。下列有关说法错误的是( )
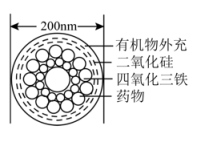 A、四氧化三铁属于无机物 B、二氧化硅属于酸性氧化物 C、该“纳米药物分子车”属于混合物 D、该“纳米药物分子车”分散于水中能形成胶体
A、四氧化三铁属于无机物 B、二氧化硅属于酸性氧化物 C、该“纳米药物分子车”属于混合物 D、该“纳米药物分子车”分散于水中能形成胶体 -
12、某公司研发出一种比锂电池成本更低、寿命更长、充电速度更快的钠离子电池,该电池的负极材料为(制备原料为、和),电解液为的碳酸丙烯酯溶液。下列化学用语正确的是( )A、的电子排布式为: B、基态碳原子的价层电子轨道表示式为
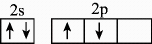 C、中子数为20的氯原子:
D、与同主族,基态原子的简化电子排布式为:
C、中子数为20的氯原子:
D、与同主族,基态原子的简化电子排布式为:
-
13、五育并举,劳动先行。下列生活应用或生产活动,没有运用相应化学知识的是( )
选项
生活应用或生产活动
化学知识
A
用SO2漂白纸张
SO2具有氧化性
B
用铝槽车运输浓硝酸
Al在冷的浓硝酸中发生钝化
C
用铁盐净水
Fe3+水解得到Fe(OH)3胶体
D
用热的纯碱溶液清洗铁屑油污
油脂在碱性条件下可水解
A、A B、B C、C D、D -
14、明矾是一种常用的净水剂,以废易拉罐(主要成分为铅和少量不溶于碱性溶液的物质)为原料制取明矾晶体的实验流程如下:
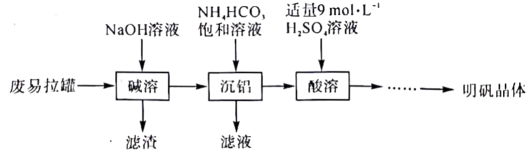
回答下列问题:
(1)、“碱溶”步骤中发生反应的化学方程式为。(2)、“沉铝”步骤在煮沸条件下进行,生成和.检验“沉铝”所得滤液中主要阳离子的定性分析操作为(填操作名称).(3)、由浓硫酸配制250mL“酸溶”所需的溶液需要用到的玻璃仪器有烧杯、玻璃棒、量筒、、。(4)、“酸溶”步骤在如图所示的装置中进行,导管的作用是。圆底烧瓶中发生反应的离子方程式为。
 (5)、“酸溶”所得的溶液经过一系列步骤后可制得明矾晶体.该系列过程中还需要加入的试剂是(填化学式)。
(5)、“酸溶”所得的溶液经过一系列步骤后可制得明矾晶体.该系列过程中还需要加入的试剂是(填化学式)。 -
15、锌、铁、铜及其化合物在生活、生产中有着广泛应用。回答下列问题:
 (1)、基态的核外电子排布式为。在第四周期过渡元素中,基态原子未成对电子数最多的元素为(用元素符号表示)。(2)、一水合甘氨酸锌是一种饲料添加剂,该化合物中所涉及的非金属元素电负性由大到小的顺序是(用元素符号表示);甘氨酸分子中N原子的杂化轨道类型为;从结构角度解释甘氨酸易溶于水的原因。(3)、铜元素的第一电离能、第二电离能分别为;锌元素的第一电离能、第二电离能分别为 , 铜的第二电离能大于锌的第二电离能,其主要原因是。(4)、磷酸铁可用于制造磷酸铁锂电池材料,的空间构型为。(5)、某种化合物由Fe、Cu、S三种元素组成,其晶胞结构如图所示,则化学式为 , 该晶胞上、下底面均为正方形,侧面与底面垂直,若该晶体的密度 , 设为阿伏加德罗常数的值,结合图中的数据计算底面棱(只要求列出计算式,用含b的代数式表示)pm。
(1)、基态的核外电子排布式为。在第四周期过渡元素中,基态原子未成对电子数最多的元素为(用元素符号表示)。(2)、一水合甘氨酸锌是一种饲料添加剂,该化合物中所涉及的非金属元素电负性由大到小的顺序是(用元素符号表示);甘氨酸分子中N原子的杂化轨道类型为;从结构角度解释甘氨酸易溶于水的原因。(3)、铜元素的第一电离能、第二电离能分别为;锌元素的第一电离能、第二电离能分别为 , 铜的第二电离能大于锌的第二电离能,其主要原因是。(4)、磷酸铁可用于制造磷酸铁锂电池材料,的空间构型为。(5)、某种化合物由Fe、Cu、S三种元素组成,其晶胞结构如图所示,则化学式为 , 该晶胞上、下底面均为正方形,侧面与底面垂直,若该晶体的密度 , 设为阿伏加德罗常数的值,结合图中的数据计算底面棱(只要求列出计算式,用含b的代数式表示)pm。 -
16、中医药是中华民族的宝库,莲花清瘟胶囊由13味中药组方而成,研究表明,其中黄酮类物质(如槲皮素、木犀草素等)对病毒有明显的抑制作用,某黄酮类化合物G的化学合成路线如图所示。
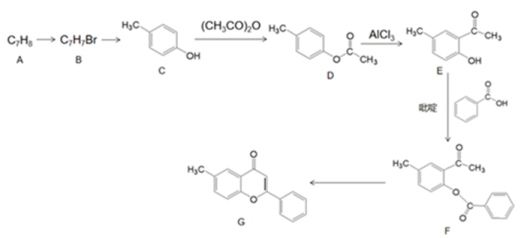
已知:
ⅰ.
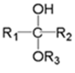 (为烃基或氢,为烃基)
(为烃基或氢,为烃基)ⅱ.
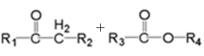
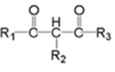 (为烃基或氢,为烃基)(1)、G的分子式为 , 其中含氧官能团的名称是。(2)、AB反应条件为。(3)、C的名称为 , 共面原子最多为。(4)、CD的化学方程式是。(5)、下列说法正确的是。(填字母序号)
(为烃基或氢,为烃基)(1)、G的分子式为 , 其中含氧官能团的名称是。(2)、AB反应条件为。(3)、C的名称为 , 共面原子最多为。(4)、CD的化学方程式是。(5)、下列说法正确的是。(填字母序号)a.最多能与或2mol NaOH反应
b.可以用酸性是否褪色检验D已完全转化为E
c.E的沸点比
 低
低d.
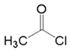 与F为同系物(6)、符合下列条件E的所有同分异构体的结构共有种。
与F为同系物(6)、符合下列条件E的所有同分异构体的结构共有种。a.苯环上的一氯代物只有两种
b.既能发生银镜反应又能发生水解反应
任写出其中一种核磁共振谱具有四组峰的结构简式。
(7)、已知的反应为可逆反应,吡啶是一种有机碱,吡啶的作用是。(8)、F经三步转化为G的路线: , 已知:中间产物1、中间产物2与F互为同分异构体,中间产物1的结构简式;第二步的反应类型是;第三步所用的试剂和条件。 -
17、印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3 , 任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl21.5mol/L,FeCl23.0mol/L,FeCl31.0mol/L,HCl3.0mol/L。取废腐蚀液200mL按如下流程在实验室进行实验:

回答下列问题:
(1)、取少量废腐蚀液于试管中,滴入1~2滴KSCN溶液,若溶液(填“红色”或“蓝色”、“紫色”),证明废液含有FeCl3。(2)、上述方法获得的铜粉中含有杂质,除杂所需试剂是(填化学式)。(3)、操作Ⅰ是 , 该操作需用到的玻璃仪器有烧杯、普通漏斗和。(4)、FeCl2溶液中通入氯气,发生反应的离子方程式为。 -
18、元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图是钠的价类二维图:

请回答以下问题
(1)、写出二维图中缺失①中某种淡黄色固体能做供氧剂的原因(用化学方程式表示,写一个即可)(2)、写出的电离方程式 ;溶液常因温度过高而分解含有少量 , 除去杂质的方法为(用离子方程式表示)。(3)、向300 mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的(忽略溶液体积的变化),充分反应后,得到和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加1mol.L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
①AB段发生反应的离子方程式 。
②B点时,反应所得溶液中溶质的物质的量浓度是。
-
19、常温下,向(一水合二甲胺)溶液中滴加0.1mol·L-1盐酸,滴定曲线如图甲所示,含C微粒的物质的量分数随pH变化如图乙所示。下列说法错误的是( )
 A、e点时,溶液中 B、S点对应溶液的pH约为11.5 C、常温下的电离常数为 D、d点时,溶液中
A、e点时,溶液中 B、S点对应溶液的pH约为11.5 C、常温下的电离常数为 D、d点时,溶液中 -
20、已知:。室温下,将稀盐酸滴加到某一元碱溶液中,测得混合溶液的pOH与微粒浓度的变化关系如图所示。下列说法错误的是( )
 A、若向溶液中加水稀释,则溶液中增大 B、室温下,BOH的电离平衡常数 C、P点所示的溶液中: D、N点所示的溶液中:
A、若向溶液中加水稀释,则溶液中增大 B、室温下,BOH的电离平衡常数 C、P点所示的溶液中: D、N点所示的溶液中: