-
1、下列说法不正确的是( )A、某硝酸密度为 , 质量分数为 , 此硝酸物质的量浓度为 B、将的氨水和的氨水等体积混合后,所得溶液的质量分数可能为小于或等于 C、浓度为的硫酸中加入一定的水稀释成 , 则加入水的体积大于 D、将标准状况下的氯化氢气体溶于水中,得到的盐酸的密度为 , 则该盐酸的物质的量浓度是
-
2、如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在室温下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复室温后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
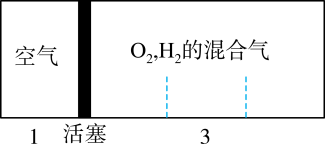 A、5:2 B、4:5 C、4:7 D、2:7
A、5:2 B、4:5 C、4:7 D、2:7 -
3、酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有、、、等。已知(亚磷酸)与足量的NaOH反应生成一种盐 , 则下列说法正确的是( )A、属于一元酸 B、属于三元酸 C、属于酸式盐 D、属于酸式盐
-
4、阿伏加德罗常数的值为 , 下列叙述中错误的是( )
①标准状况下,水中含有个水分子
②常温常压下,含有的分子数约为
③的摩尔质量为
④的气体摩尔体积约为
⑤标准状况下,由和组成的混合气体中,所含氮原子的物质的量为
⑥的溶液中的数目为
⑦常温常压下,氦气含有的原子数为
A、①③④⑥ B、③⑤⑥⑦ C、①②③⑤ D、②④⑥⑦ -
5、取和组成的混合气体 , 通入到盛足量固体粉末的容器中,并同时加入足量的 , 电火花引燃,充分反应后,称重发现固体粉末的质量增加了3.6g,则原混合气体中和质量比为( )A、7:2 B、6:5 C、2:3 D、1:4
-
6、图a~c分别为氯化钠在不同状态下的导电实验(X、Y均表示石墨电极,X与电源正极相连,Y与电源负极相连)微观示意图。下列说法正确的是( )
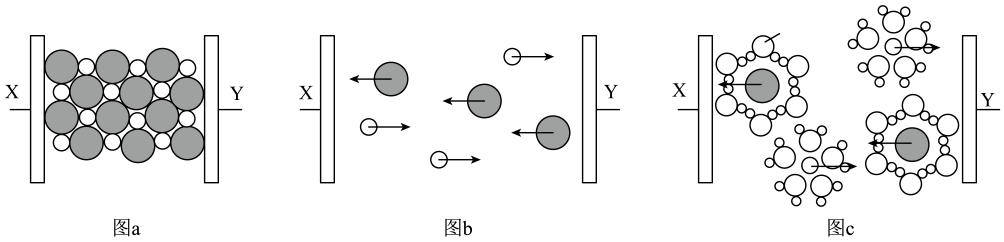 A、图示中
A、图示中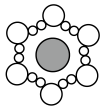 代表的是水合钠离子
B、氯化钠只有在通电条件下才能电离
C、图b表示熔融状态下氯化钠的导电过程
D、氯化钠在不同状态下均能导电
代表的是水合钠离子
B、氯化钠只有在通电条件下才能电离
C、图b表示熔融状态下氯化钠的导电过程
D、氯化钠在不同状态下均能导电
-
7、如表所示,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
陈述Ⅰ
陈述Ⅱ
判断
A
中的少量杂质可将气体通入饱和溶液除去
可与反应
Ⅰ对,Ⅱ对,有
B
用洁净的铂丝蘸取某溶液进行焰色试验,火焰为黄色
该溶液一定是钠盐的溶液
Ⅰ对,Ⅱ对,有
C
金属钠具有强还原性
高压钠灯发出透雾性强的黄光
Ⅰ对,Ⅱ对,有
D
过氧化钠可为航天员供氧
能与和反应生成
Ⅰ对,Ⅱ对,有
A、A B、B C、C D、D -
8、下列关于钠及其化合物的叙述不正确的是( )A、实验室应将少量钠保存在煤油中 B、金属钠着火时,可用干燥的细沙覆盖灭火 C、钠切开后,光亮的表面迅速变暗,是因为生成了Na2O2 D、用加热的方法可除去Na2CO3粉末中含有的少量NaHCO3
-
9、下列反应的离子方程式中,书写正确的是( )A、将稀硫酸滴在铁片上: B、溶于过量的溶液中: C、硝酸银溶液与铜反应: D、用小苏打治疗胃酸过多:
-
10、下列物质的转化,不能由一步反应实现的是( )A、 B、 C、 D、
-
11、中国古代诗词和书籍中蕴含着化学知识。下列说法错误的是( )A、《天工开物》中“凡石灰,经火焚炼为用”涉及的反应类型是分解反应 B、《神农本草经》中提到:“白青得铁化为铜”,其中白青属于碱 C、“墨滴无声入水惊,如烟袅袅幻形生”中的“墨滴”是一种分散系 D、《本草纲目》:“水银乃至阴之票物,因火煅丹砂而出”,其中发生了氧化还原反应
-
12、回答下列问题:(1)、某工业废水中存在大量的 , 欲除去其中的 , 设计提纯流程如图所示:
①试剂b溶液为(化学式),试剂c溶液为(化学式)。
②操作X为。
(2)、“”试剂可将氧化为可溶的 , 而作为废气中的脱除剂。①催化分解产生有很强的氧化性的 , 将氧化为的机理如图所示,Y的化学式为。

②与反应生成的化学方程式为。
③脱除率随温度的变化如题图所示,温度高于120℃时,脱除率随温度升高呈现下降趋势的主要原因是。
 (3)、一个密闭容器中有可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入 , 右边充入和的混合气体共时,隔板处于如下图位置(保持温度不变)。
(3)、一个密闭容器中有可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入 , 右边充入和的混合气体共时,隔板处于如下图位置(保持温度不变)。
①右边和分子数之比为。
②右侧气体密度与相同条件下氧气密度之比为。
-
13、工业上以侯氏制碱法为基础生产焦亚硫酸钠()的工艺流程如下:
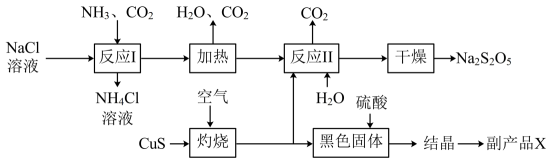 (1)、反应1的化学方程式为;在进行反应时,向溶液中先通入 (填“” 或“”);(2)、已知“灼烧时会生成 , 则其化学方程式为;(3)、已知与稀硫酸反应会生成 , 则其离子方程式为;(4)、副产品X化学式为;该生产中可循环利用的物质为(化学式)。(5)、为了减少产品中的杂质含量,理论上需控制反应II中气体与固体反应物的物质的量之比为。
(1)、反应1的化学方程式为;在进行反应时,向溶液中先通入 (填“” 或“”);(2)、已知“灼烧时会生成 , 则其化学方程式为;(3)、已知与稀硫酸反应会生成 , 则其离子方程式为;(4)、副产品X化学式为;该生产中可循环利用的物质为(化学式)。(5)、为了减少产品中的杂质含量,理论上需控制反应II中气体与固体反应物的物质的量之比为。 -
14、某学习小组探究潮湿的与反应的产物,进行如下实验:
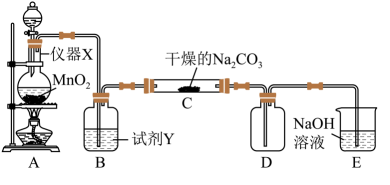
请回答:
(1)、仪器X的名称是:。(2)、装置E的作用是:;试剂Y是。(3)、请写出装置A中发生的离子方程式。(4)、装置C中潮湿的与以等物质的量反应,生成、气体和另一种盐,试写出该反应化学方程式:。(5)、设计实验方案验证C中生成的固体中存在。 -
15、化学研究中应当学会实验与探究、归纳与演绎、分析与综合等方法的运用。回答下列问题:(1)、I.现有下列10种物质:
①冰水混合物 ②有色玻璃 ③ ④ ⑤熔融 ⑥溶液 ⑦ ⑧硫酸溶液 ⑨ ⑩固体。
属于分散系的是 , 属于强电解质且能导电的是 , 属于非电解质的是。(2)、向⑥溶液中滴加用⑩物质配制的溶液,至恰好完全沉淀时的离子方程式:。(3)、Ⅱ.完成下列问题溶液能用作中毒的解毒剂反应可生成P的最高价含氧酸和铜;该反应的化学方程式是。
(4)、汽车剧烈碰撞时,安全气囊中发生反应:。该反应中氧化产物与还原产物的质量比为;若氧化产物比还原产物多 , 则反应生成的在标准状况下的体积为L。 -
16、已知碳酸氢钙是一种易溶于水的白色固体,受热易分解。某小组取质量为的碳酸氢钙样品进行加热分解实验,加热过程中剩余固体的质量随加热时间的变化如图一所示。经查阅资料发现,碳酸氢钙能与盐酸反应,也能与石灰水反应。于是,他们构建了由碳酸氢钙转化为二氧化碳的不同路径反应转化关系如图二、
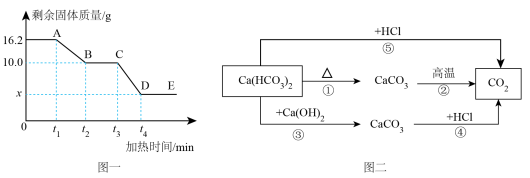
下列说法错误的是( )
A、图一中,A、C、D三点对应的固体中所含钙元素质量相等 B、图一中,若向A点所示固体中加入足量稀盐酸,充分反应生成的质量为 C、图二中,相同质量的在反应①、②生成的总质量大于反应④生成的质量 D、图二中,相同质量的在反应⑤中消耗的质量小于在反应④中消耗的质量 -
17、向含的溶液中通入一定体积的使其充分反应,再向所得溶液中逐滴滴加稀盐酸。测得产生的物质的量随加入的物质的量变化如图所示。则下列说法错误的是( )
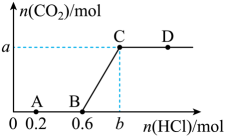 A、A点之前发生的离子反应为 B、图中的 C、在D点对应的溶液中,不能大量共存 D、向氢氧化钠溶液中通入的体积为
A、A点之前发生的离子反应为 B、图中的 C、在D点对应的溶液中,不能大量共存 D、向氢氧化钠溶液中通入的体积为 -
18、一定温度和压强下,用质量相等的四种气体吹出四个体积大小不同的气球,下列说法中不正确的是( )
 A、气球②中装的是 B、气球①和气球③中气体分子数相等 C、气球①和气球②中原子数之比为 D、气球③和气球④中气体体积之比为
A、气球②中装的是 B、气球①和气球③中气体分子数相等 C、气球①和气球②中原子数之比为 D、气球③和气球④中气体体积之比为 -
19、下列实验方案中,不能测定和固体混合物中质量分数的是( )A、取混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重 B、取混合物与足量稀盐酸充分反应,加热、蒸干灼烧,得固体 C、取混合物充分加热,固体质量减少 D、取混合物与足量溶液充分反应,过滤、洗涤、烘干,得固体
-
20、下列说法错误是( )A、分别以高锰酸钾、氯酸钾、过氧化氢为原料制取相同质量的氧气,转移的电子的物质的量之比为 B、已知在碱性溶液中可发生反应: , 则中R的化合价是+6 C、在碱性条件下可被氧化为 , 而被还原为 , 若反应中与的物质的量之比为 , 则x值为5 D、与一定浓度的溶液反应,生成和。当的个数之比为时,平参加反应的与的物质的量之比为