-
1、部分弱电解质的电离常数如下表:
弱电解质
HCOOH
HCN
电离常数(25℃)
、
下列说法错误的是( )
A、根据电离常数,可判断酸性 B、等体积、等浓度的HCOONa和NaCN溶液中离子总数:前者小于后者 C、向NaCN溶液中通入少量 , 离子方程式为: D、25℃时,反应的化学平衡常数为 -
2、常温下,下列说法正确的是( )A、pH=8的溶液中,水电离产生的 B、pH相等的、NaOH和三种溶液: C、将等体积等物质的量浓度的和NaF溶液混合: D、0.1mol/L 溶液与0.1mol/L 溶液中:前者小
-
3、在恒温恒容条件下,发生反应: , 测得与时间关系如图,下列叙述错误的是( )
 A、a~b段CO平均速率 B、其他条件不变,相对甲曲线,乙曲线加入催化剂 C、不同时刻均存在 D、b点逆反应速率小于c点正反应速率
A、a~b段CO平均速率 B、其他条件不变,相对甲曲线,乙曲线加入催化剂 C、不同时刻均存在 D、b点逆反应速率小于c点正反应速率 -
4、按如图所示的实验装置或方案进行实验,能达到相应实验目的的是( )
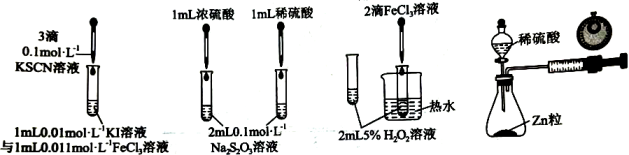
甲 乙 丙 丁
A、用甲证明KI与的反应存在一定的限度 B、用乙探究浓度对化学反应速率的影响 C、用丙验证对分解反应有催化作用 D、用丁比较不同浓度的稀硫酸与锌反应的速率大小 -
5、标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下,已知(g)和(g)的相对能量为0,下列说法正确的是( )
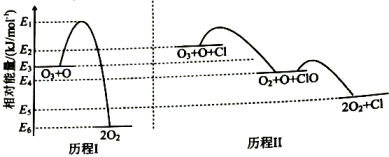 A、ClO在历程Ⅱ中作催化剂 B、相同条件下,的平衡转化率:历程Ⅱ>历程Ⅰ C、的 D、历程Ⅱ中速率最慢的一步反应的执化学方程式为
A、ClO在历程Ⅱ中作催化剂 B、相同条件下,的平衡转化率:历程Ⅱ>历程Ⅰ C、的 D、历程Ⅱ中速率最慢的一步反应的执化学方程式为 -
6、Burns和Dainton研究发现与CO合成的反应机理如下:
① 快
② 快
③ 慢
其中反应②存在;。下列说法正确的是( )
A、反应②的平衡常数 B、反应①②的活化能均大于反应③ C、增加CO(g)浓度能增加活化分子百分数,加快反应速率 D、COCl·是该反应的催化剂 -
7、用0.65g锌粒与10mL 1.0mol/L硫酸反应制氢气,下列措施能加快反应速率且不改变氢气的产量,下列操作可行的有几项( )
①用等质量的锌粉代替锌粒
②将反应溶液适当加热
③向反应液中滴入少量溶液
④用10mL 98%硫酸代替10mL 1.0mol/L的硫酸
⑤再加入10mL 2.0mol/L盐酸
⑥向反应液中加入少量固体
A、2 B、3 C、4 D、5 -
8、下列说法正确的是( )A、铵盐的溶解、酸碱中和反应、电解熔融氧化铝都是自发过程 B、常温下自发,说明反应放热,且化学反应速率快 C、室温下,(g)和(g)混合无液态水生成,说明 D、已知 , T=980K时, , 则当温度低于980K时,CO将发生分解
-
9、下列叙述正确的是( )A、已知P(白磷,s)=P(红磷,s) , 则白磷比红磷稳定 B、已知 , , 则 C、已知 , 向密闭容器中加入2mol 和2mol (g),充分反应后放出的热量小于2a kJ D、已知 , 则含1mol NaOH的稀溶液与足量稀醋酸,完全中和,放出的热量等于57.3kJ
-
10、丙烯是重要的有机原料,由丙烷制备丙烯是近年来研究的热点,主要涉及如下反应。
反应ⅰ:
反应ⅱ:
回答下列问题:
(1)、反应: 。(2)、在恒容绝热容器中通入和 , 若只发生反应ⅰ,下列能说明已经达到平衡状态的有____(填序号)。A、每断裂1mol O=O键的同时生成4mol O-H键 B、容器内温度不再变化 C、混合气体的密度不再变化 D、容器内保持不变(3)、在压强恒定为100kPa条件下,按起始投料 , 匀速通入装有催化剂的反应器中发生反应ⅰ和反应ⅱ,其中相同时间内不同温度下丙烷和氧气的转化率如图所示。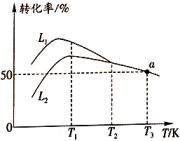
①曲线(填“”或“”)表示丙烷的转化率。
②温度高于K后曲线随温度升高而降低的原因为。
③当温度高于(填“”或“”)时,可判断反应ⅱ不再发生的依据是。a点对应的温度下,丙烯的分压kPa(保留3位有效数字,后同),反应ⅰ的平衡常数kPa(以分压表示,分压=总压×物质的量分数)。
-
11、实验室以天青石精矿(主要含 , 还含有少量的、、)为原料制取 , 其实验流程如图所示:
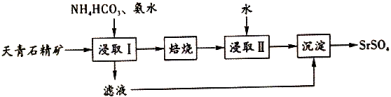 (1)、室温下,反应达到平衡,则反应的平衡常数为(结果保留至0.1)。[ , ](2)、已知常温下, , , 。
(1)、室温下,反应达到平衡,则反应的平衡常数为(结果保留至0.1)。[ , ](2)、已知常温下, , , 。①常温下,0.1 溶液中(填“>”“<”或“=”)。
②常温下,实测某人血液中 , , 则人体血液呈
性。
③浸取天青石精矿时,向溶液中加入适量浓氨水的目的是。
(3)、“沉淀"过程中除得到外,还得到一种可循环利用的物质,该物质为。(4)、“浸取Ⅰ”的条件是温度在60~70℃,搅拌、反应3小时,温度过高将会导致的转化率下降,其原因是。(5)、将与煤粉按照一定比例混合后高温煅烧得到一种黑灰(SrS),写出其反应的化学方程式:(写出一个即可)。(6)、检验“沉淀”步骤中是否沉淀完全的方法:。 -
12、水溶液中存在离子平衡,请回答下列问题:(1)、水溶液呈(填“酸”“中”或“碱”)性,原因是(用离子方程式表示)。(2)、已知T℃时,纯水中 , 则
①该温度时0.1mol/L NaOH溶液的pH为。
②该温度下,将pH=2的溶液与pH=9的NaOH溶液按体积比1∶9混合(忽略溶液体积变化),所得混合溶液的pH为。
③该温度下,若1体积的某强酸溶液与10体积的某强碱溶液混合后溶液呈中性(忽略溶液体积变化),则混合前,a与b之间应满足的关系是。
(3)、常温下,向25mL的氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示。
①该氢氧化钠溶液的浓度为mol/L。
②在B点,溶液中离子浓度大小关系为。
③在D点,(填“<”“>”或“=”)。
-
13、充满HCl气体(标准状况)的烧瓶做完喷泉实验后得到的稀盐酸溶液,用标准氢氧化钠溶液滴定,以准确确定该稀盐酸的物质的量浓度。回答下列问题:(1)、若酸式滴定管的量程为25mL,调液面处于5刻度,将该滴定管中所有液体放出,则放出的溶液体积(填“大于”“小于”或“等于”)20mL。(2)、配制三种不同浓度的标准氢氧化钠溶液,你认为最合适的是(填序号)
①5.000mol/L ②0.5000mol/L ③0.0500mol/L
(3)、润洗装标准氢氧化钠溶液的滴定管的操作为:从滴定管上口加入3~5mL氢氧化钠溶液,倾斜着转动滴定管,使液体润湿全部滴定管内壁,然后将液体从滴定管下部放入烧杯中。滴定前应先排气泡,排气泡时,应选择下图中的(填序号)。 (4)、若该滴定实验用酚酞作指示剂,达到滴定终点时的现象为。(5)、下列操作会导致所测稀盐酸的物质的量浓度偏大的是____(填序号)。A、不小心将标准液滴至锥形瓶外 B、滴定前,碱式滴定管有气泡,滴定后消失 C、刚变色后则立即记下数据 D、若用含有杂质的氢氧化钠固体配制标准溶液(6)、若采用上述合适的标准氢氧化钠溶液滴定稀盐酸,操作步骤合理,滴定后的实验数据如表所示:
(4)、若该滴定实验用酚酞作指示剂,达到滴定终点时的现象为。(5)、下列操作会导致所测稀盐酸的物质的量浓度偏大的是____(填序号)。A、不小心将标准液滴至锥形瓶外 B、滴定前,碱式滴定管有气泡,滴定后消失 C、刚变色后则立即记下数据 D、若用含有杂质的氢氧化钠固体配制标准溶液(6)、若采用上述合适的标准氢氧化钠溶液滴定稀盐酸,操作步骤合理,滴定后的实验数据如表所示:实验编号
测稀盐酸的体积(mL)
待滴氢氧化钠溶液前刻度
滴氢氧化钠溶液后刻度
1
20.00
5.00
22.00
2
20.00
4.50
21.52
3
20.00
5.20
22.18
测得的稀盐酸的物质的量浓度为mol/L。
-
14、25℃时,在10mL浓度均为0.1mol/L的NaOH和混合溶液中滴加0.1mol/L盐酸,所得滴定曲线如图所示。下列有关溶液中粒子浓度关系正确的是( )
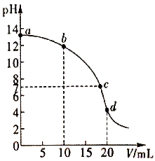 A、a点溶液中: B、b点溶液中: C、c点溶液中: D、d点溶液中:
A、a点溶液中: B、b点溶液中: C、c点溶液中: D、d点溶液中: -
15、常温下,AgCl(白色)与(砖红色)的沉淀溶解平衡曲线如图所示, , , 或。下列说法错误的是( )
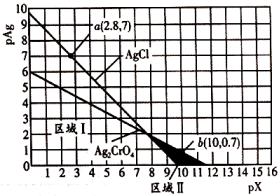 A、 B、区域Ⅰ只存在AgCl沉淀,区域Ⅱ只存在沉淀 C、向、均为0.1mol/L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀 D、反应的平衡常数K为
A、 B、区域Ⅰ只存在AgCl沉淀,区域Ⅱ只存在沉淀 C、向、均为0.1mol/L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀 D、反应的平衡常数K为 -
16、一定温度下,水溶液中和的物质的量浓度变化曲线如图所示,下列说法不正确的是( )
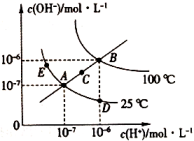 A、图中五点对应的间的关系: B、从A点到E点,可采用在水中加入少量NaOH或的方法 C、从A点到D点,所得D点溶液中水电离产生的的物质的量浓度不可能为 D、若处在B点时,将pH=2的硫酸溶液与pH=10的KOH溶液等体积混合,所得溶液呈中性
A、图中五点对应的间的关系: B、从A点到E点,可采用在水中加入少量NaOH或的方法 C、从A点到D点,所得D点溶液中水电离产生的的物质的量浓度不可能为 D、若处在B点时,将pH=2的硫酸溶液与pH=10的KOH溶液等体积混合,所得溶液呈中性 -
17、25℃时,取pH=11的X、Y两种碱溶液各10mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
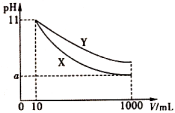 A、X、Y两种碱的物质的量浓度一定相等 B、稀释后,X溶液的碱性比Y溶液的碱性强 C、完全中和所取的X、Y两种溶液时,消耗同物质的量浓度盐酸的体积关系为 D、若 , 则X、Y都是弱碱
A、X、Y两种碱的物质的量浓度一定相等 B、稀释后,X溶液的碱性比Y溶液的碱性强 C、完全中和所取的X、Y两种溶液时,消耗同物质的量浓度盐酸的体积关系为 D、若 , 则X、Y都是弱碱 -
18、下列关于盐类水解的说法不正确的是( )A、向溶液中加入少量固体,的水解程度增大 B、将溶液由20℃加热到60℃,溶液的pH减小 C、向溶液中加水,溶液中的比值减小 D、常温下,0.1mol/L的NaB溶液的pH=8,溶液中
-
19、低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为 。在但容的密闭容器中,下列有关说法不正确的是( )A、其他条件不变,使用高效催化剂,会缩短反应时间但废气中氮氧化物的转化率不变 B、其他条件不变,加入足量的 , 再次平衡后氮氧化物的转化率增大 C、其他条件不变,升高温度会提高反应物的转化率且使该反应的平衡常数增大 D、其他条件不变,缩小容器的体积会使平衡逆向移动,再次平衡后氨气的浓度变大
-
20、 反应过程中的能量变化如图所示,下列有关叙述不正确的是( )
 A、 B、该反应中,反应物的总键能大于生成物的总键能 C、使用催化剂可降低反应的活化能 D、该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
A、 B、该反应中,反应物的总键能大于生成物的总键能 C、使用催化剂可降低反应的活化能 D、该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数