-
1、2023年第19届杭州亚运会呈现了一届“中国特色、浙江风采、杭州韵味、精彩纷呈”的体育文化盛会。下列亚运会事项中发生化学变化的是( )A、开幕式燃放数字烟花 B、播放具有感染力的音乐 C、机械狗运送铁饼 D、汪顺和数字人共同点燃主火炬
-
2、研究化学反应中的能量和速率变化对生产、生活有着重要意义。(1)、I.某些常见化学键的键能(将气体分子AB断裂为中性气态原子A和B所需的能量或A和B合成1molAB气体所放出的能量)数据如下表:
完全燃烧生成和气态水放出的能量为kJ。该反应中反应物的总能量(填“>”、“<”或“=”)生成物的总能量。化学键
键能/()
414
803
463
498
(2)、II.实验室模拟热气循环法合成尿素,与在一定条件下发生反应:。为了验证反应温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
实验编号
初始浓度/()
初始浓度/()
催化剂的比表面积/()
①
280
82
②
③
350
a
82
控制变量是科学研究的重要方法,因此表中数据: , 。
(3)、对比实验①③,目的是验证(填“反应温度”或“催化剂的比表面积”)对化学反应速率的影响规律。(4)、一定温度下,向1L密闭容器中充入和发生反应: , 若起始压强为 , 反应2min后该反应达到化学平衡状态,平衡时的压强是起始时的0.8倍,则0~2min内, , 的平衡转化率为%。(5)、下列情况中,一定能说明上述反应达到平衡的是____(填标号)。A、的体积分数保持不变 B、反应体系中气体的密度保持不变 C、反应消耗 , 同时生成 D、的质量保持不变(6)、“碳呼吸电池”是一种新型化学电源,其工作原理如图。当得到时,电路中转移的电子的物质的量为mol。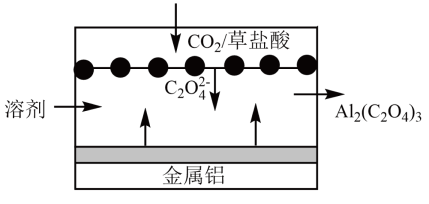
-
3、宏观辨识与微观探析是化学学科核心素养之一、根据所学知识,回答下列问题:(1)、拟卤离子主要有、、 , 性质与卤离子相似,它们相应的中性分子性质与卤素单质也相似。
①已知还原性; , 写出酸性条件下加热时,和KSCN(aq)反应的离子方程式:。
②与水反应生成的含氧酸的结构式为。氰化提金工艺在黄金生产领域仍占主导地位,但会产生大量含氰()废水,含氰废水中加入足量的 , 发生反应的离子方程式为。理论上处理含氰废水(含),需要消耗g(保留2位小数)。按照理论值投放,含氰废水处理效果并不理想,请分析原因:。
(2)、酒精仪中酸性重铬酸钾(稀硫酸酸化)可将乙醇氧化成乙酸,本身被还原成。写出该反应的离子方程式:;在该反应中还原剂是(填化学式)。氧化23g乙醇时转移电子的物质的量为。(3)、和都属于离子型化合物,前者跟水反应生成和 , 写出跟水反应的化学方程式:。 -
4、生物地球氮化学循环模式图的一部分如图,请根据所学知识回答问题。
已知:硝化作用是在有氧的条件下,氨或铵根经亚硝酸细菌和硝酸细菌的作用转化为硝酸的过程。铵根浓度或pH过大,都会使硝化作用减弱。
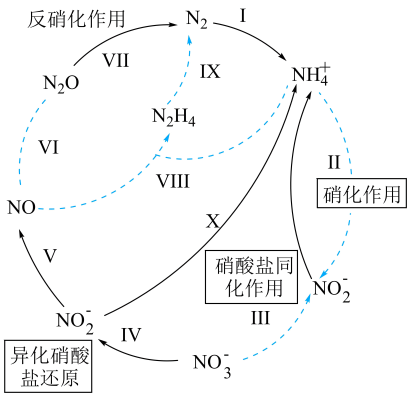 (1)、属于氮的固定的是(填标号)。(2)、利用如图装置可以制备、检验和收集NO。
(1)、属于氮的固定的是(填标号)。(2)、利用如图装置可以制备、检验和收集NO。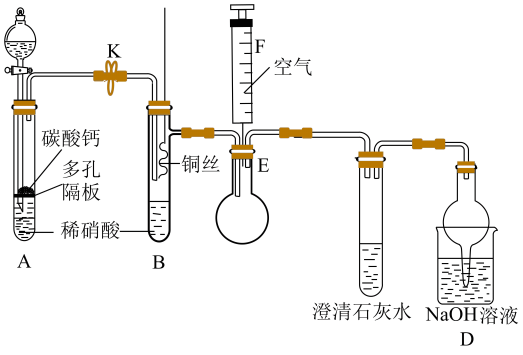
①实验前先打开开关K通入一段时间,其目的是。采用抽拉铜丝与稀硝酸反应的优点为。
②检验生成的气体为NO的操作是。
③装置D的作用是。
(3)、NO与反应生成的离子方程式为 , 该反应中氧化产物与还原产物的物质的量之比为。(4)、写出铵根经硝化作用直接转化为硝酸根的离子方程式: , 铵根浓度或pH过大,都会使硝化作用减弱的可能原因为。 -
5、主族元素A、B、C、D、E、F、G、H在元素周期表中的相对位置如图所示。已知上述8种元素的原子最外层电子数之和等于47,C与H的质子数之和为43.请回答下列问题:
A
B
C
D
E
F
G
H
(1)、G在元素周期表中位于第周期第族。(2)、在C、D、G的最简单氢化物中,最不稳定的是(填化学式),常温下,B的最简单氢化物的水溶液的pH(填“>”、“<”或“=”)7.(3)、单质A(填“能”或“不能”)与B的最高价氧化物对应的水化物的浓溶液发生反应。(4)、E的简单氢化物通入胆矾溶液中,产物含红色单质和两种最高价含氧酸,该反应的离子方程式为。(5)、3molF单质通入热KOH溶液中完全反应,共转移5mol电子。在该反应中,氧化剂与还原剂的质量之比为。(6)、一定条件下,AC、BC和熔盐(能传导)能形成原电池(产物为无污染气体),其中负极通入的是(填化学式),正极的电极反应为。 -
6、某固体混合物可能由、、FeS、、、中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是( )
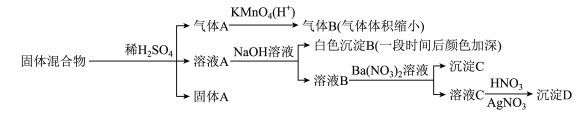 A、气体A中一定含有 B、固体A中一定含有S和 C、该固体混合物至少含和FeS中的一种 D、该固体混合物中一定含有、、
A、气体A中一定含有 B、固体A中一定含有S和 C、该固体混合物至少含和FeS中的一种 D、该固体混合物中一定含有、、 -
7、某温度下,在2L恒容密闭容器中加入3.0molX,发生反应 , 反应过程中有关数据如下表:
时间/min
0
5
10
15
20
25
Z的物质的量/mol
0
0.1
0.18
0.25
025
0.25
下列说法错误的是( )
A、5min时,Y的浓度为 B、0~10min内,Y的平均反应速率为 C、当容器内的值不变时,该反应达到平衡状态 D、当混合气体的密度不再改变时,该反应达到最大限度 -
8、由W、X、Y、Z四种原子序数依次增大的短周期主族元素组成的化合物M可作肥料,W、X、Y、Z分属三个短周期,其中X、Z位于同一主族,Y是地壳中含量最多的元素,且四种元素的原子序数之和为31,下列说法正确的是( )A、由W、X组成的某种化合物与水可形成分子间氢键 B、最简单氢化物的稳定性:X>Z>Y C、简单离子半径:X>Z>Y D、Z的最高价氧化物对应的水化物为二元强酸
-
9、下列实验操作或做法正确且能达到目的的是( )
选项
实验操作或做法
目的
A
向盛有固体的锥形瓶中滴加稀盐酸,产生无色气体
证明氯元素的非金属性强于硫元素
B
实验室将生成的乙酸乙酯导入饱和的溶液中,分液
使乙酸乙酯产品更加纯净
C
向2支盛有5 mL不同浓度溶液的试管中同时加入2 mL 5%的溶液,观察实验现象
探究浓度对反应速率的影响
D
向淀粉水解液中直接加入新制银氨溶液并水浴加热,未形成银镜
说明淀粉未发生水解
A、A B、B C、C D、D -
10、下列方程式正确的是( )A、向溴的四氯化碳溶液中通入乙烯,溶液褪色: B、向明矾溶液中加入过量氨水: C、用稀硝酸除去铜粉中的少量铁粉: D、向溴水中通入 , 溶液褪色:
-
11、属于钠的化合物,具有很强的氧化性。少量与溶液能发生如下反应:(方程式未配平),设为阿伏加德罗常数的值,下列说法错误的是( )A、1L 1 溶液含的数目为2 B、1mol 可制得的胶粒数为 C、78g 含有共价键的数目为 D、每生成1mol X,转移的电子数为
-
12、异硫氰酸荧光素酯()能和各种抗体蛋白结合,广泛应用于医学、农学和畜牧等方面,其结构简式如图所示。下列有关的说法正确的是( )
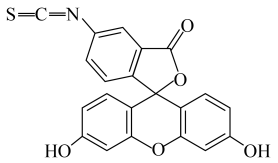
已知:连有四个不同的基团或原子团的碳原子称为手性碳原子。
A、分子中含有18个碳原子 B、分子中所有原子可能共平面 C、能发生取代反应和加成反应 D、分子中含有手性碳原子 -
13、通过测定混合气中含量可计算已变质的(含)纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是( )
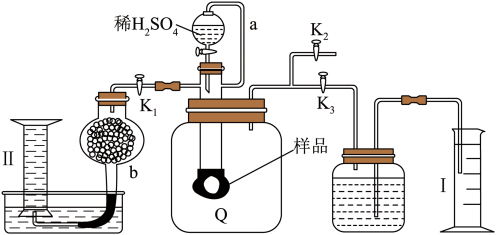 A、Q气囊中产生的气体主要成分为、 B、测定气体总体积必须关闭、 , 打开 C、读完气体总体积后,关闭 , 缓缓打开 , 可观察到Q气囊慢慢缩小 D、量筒I用于测二氧化碳的量,干燥管b中装入碱石灰,量筒Ⅱ用于测氧气的量
A、Q气囊中产生的气体主要成分为、 B、测定气体总体积必须关闭、 , 打开 C、读完气体总体积后,关闭 , 缓缓打开 , 可观察到Q气囊慢慢缩小 D、量筒I用于测二氧化碳的量,干燥管b中装入碱石灰,量筒Ⅱ用于测氧气的量 -
14、下列物质的转化在给定条件下不能实现的是( )A、 B、 C、 D、
-
15、化学上,将质量数相同、质子数不同的核素称为同量素。某核聚变方程为。下列说法错误的是( )A、在NaOH溶液中X的金属性比Y的强 B、和互为同量素 C、与互为同位素 D、X、Y最外层电子数之比为
-
16、下列有关物质的性质与用途不具有对应关系的是( )
选项
物质
性质
用途
A
硬度大
可制作砂轮磨料
B
具有还原性
可用于水处理中脱氧
C
受热易分解
可用作氮肥
D
不溶于水和酸,不易被X射线透过
可用作钡餐造影剂
A、A B、B C、C D、D -
17、下列化学用语表述正确的是( )A、聚丙烯酸乙酯的结构简式: B、中子数为8的碳原子: C、羟基的电子式:
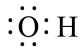 D、熔融状态下的电离方程式:
D、熔融状态下的电离方程式:
-
18、文物凝结了人类智慧的结晶,也是历史进步的标志。下列文物的材质为合金的是( )




A.清光绪千金猴王砚
B.西周兽面纹青铜盉
C.木雕罗汉坐像
D.雪梅双鹤图
A、A B、B C、C D、D -
19、工业上纳米的制备过程是以为载体,用和水蒸气反应生成 , 再控制温度生成纳米 , 测定产物组成的方法如下:
步骤一:取样品3.120 g用稀硫酸充分溶解得到溶液,再用足量铝将还原为 , 过滤并洗涤,将所得滤液和洗涤液混合并注入250 mL容量瓶,定容得到待测液。
步骤二:取待测液于锥形瓶中,加入几滴指示剂,用0.100 mol/L的标准溶液滴定,将氧化为 , 三次滴定测得数据记录如下:
实验编号
待测溶液的体积/mL
滴定前标准液的体积读数/mL
滴定后标准液的体积读数/mL
1
25.00
0.20
30.22
2
25.00
1.21
32.21
3
25.00
1.50
31.48
回答下列问题:
(1)、若对步骤一所得的溶液加水稀释,溶液中会产生少量偏钛酸()沉淀,写出该反应的离子方程式。(2)、已知溶液显酸性,滴定时,将标准溶液注入(填“酸”或“碱”)式滴定管中。选出其正确操作并按顺序写出字母:检查滴定管是否漏水→蒸馏水洗涤→→→→→→滴定管准备完成。a.从滴定管上口加入高于“0”刻度2-3 mL所要盛装的溶液
b.将洗涤液从滴定管下部放入预置的烧杯中
c.从滴定管上口加入3 mL所要盛装的溶液,倾斜着转动滴定管
d.将洗涤液从滴定管上口倒入预置的烧杯中
e.调整液面至“0”刻度或“0“刻度以下,记录数据
f.轻轻转动活塞使滴定管的尖嘴部分充满溶液,无气泡
g.轻轻挤压玻璃球使滴定管的尖嘴部分充满溶液,无气泡
(3)、上述滴定实验中,可选择为指示剂,判断到达滴定终点的方法是。(4)、下列关于滴定分析的操作,错误的是____。A、用量筒量取25.00 mL待测液转移至锥形瓶 B、滴定时要适当控制滴定速率 C、滴定时应一直观察滴定管中溶液体积的变化 D、平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下 E、在接近终点时,滴加药品应慢慢控制滴定管,使滴定管尖嘴悬挂半滴液体,用锥形瓶内壁将其靠下,并用蒸馏水将其冲入锥形瓶内(5)、通过分析、计算,该样品的组成为;若滴定前平视读数,滴定后俯视读数,则测得比实际值(填“偏大”、“偏小”或“无影响”)。 -
20、硫酸铈铵是分析化学常用的滴定剂。以氟碳铈矿(含、、等)为原料制备硫酸铈铵的工艺流程如图所示。

已知部分信息如下:
①在空气中易被氧化为
②“沉铈”时发生的反应之一:
回答下列问题:
(1)、中铈元素的化合价价,“滤渣A”的主要成分是(填化学式)。(2)、“焙烧”中常采用高压空气、逆流操作(空气从焙烧炉下部通入,矿粉从中上部加入),这样操作的目的是。(3)、“酸浸”中,铈浸出率与温度的关系如图1所示,铈浸出率与硫酸浓度的关系如图2所示。工业生产应选择的适宜条件是。 (4)、“灼烧”时需要的主要实验仪器有酒精灯、三脚架。(5)、“沉铈”时,硫脲作(填“还原剂”或“氧化剂”)。(6)、“溶解”时,为防止Ce³⁺被氧化,可以加入(填标号)。
(4)、“灼烧”时需要的主要实验仪器有酒精灯、三脚架。(5)、“沉铈”时,硫脲作(填“还原剂”或“氧化剂”)。(6)、“溶解”时,为防止Ce³⁺被氧化,可以加入(填标号)。a. b.NaClO c.
(7)、写出生成过程的离子方程式:。