-
1、碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
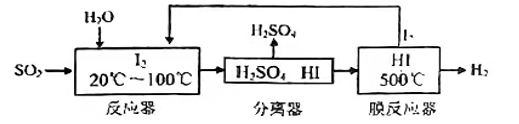
下列说法正确的是( )
A、分离器中的物质分离操作为过滤 B、膜反应器中,加入催化剂可以改变该反应的焓变 C、该工艺中I2和HI的相互转化体现了“碘循环” D、碘循环工艺的总反应为 -
2、为确定Fe2O3和Cu混合物的组成(假设混合均匀),某兴趣小组称取五份不同质量的样品,分别投入30.0mL某浓度的稀硫酸中。充分反应后,每组样品剩余固体的质量与原样品质量的关系如图所示。下列说法不正确的是( )
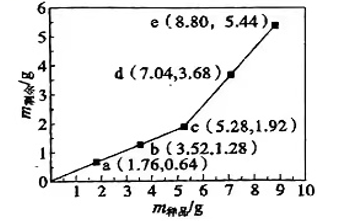 A、各组样品均发生反应:、 B、1.76g样品充分反应后,溶液中一定存在Fe2+和Cu2+ , 一定不存在Fe3+ C、该混合物中n(Fe2O3):n(Cu)=3:1 D、稀硫酸的浓度为1.5mol·L-1
A、各组样品均发生反应:、 B、1.76g样品充分反应后,溶液中一定存在Fe2+和Cu2+ , 一定不存在Fe3+ C、该混合物中n(Fe2O3):n(Cu)=3:1 D、稀硫酸的浓度为1.5mol·L-1 -
3、我国科学家在合成气直接制烯烃方面的研究获重大突破。已知:
下列说法不正确的是( )
A、△H1-△H2<0 B、反应②为吸热反应 C、 D、 -
4、某工厂拟综合处理含NH4+的废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计如图所示流程:
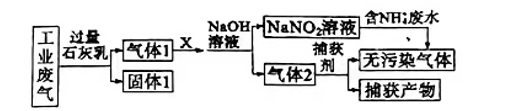
下列说法不正确的是( )
A、固体I中主要含有CaCO3、CaSO3、Ca(OH)2 B、X可以是空气,但不能过量 C、捕获剂所捕获的气体主要是CO、N2 D、处理含NH4+废水时,发生的反应为 -
5、某无色澄清溶液可能含有Na+、Mg2+、Al3+、Ba2+、Fe3+、Cl-、SO42-、CO32-中的若干种,取样分别进行如下实验:
①逐滴加入NaOH溶液,有白色沉淀生成,继续滴加至过量,沉淀部分溶解。
②加足量BaCl2溶液,产生白色沉淀,再向沉淀中加入过量稀盐酸,沉淀质量不变。
下列说法错误的是( )
A、原溶液中一定存在SO42-、Mg2+、Al3+ B、原溶液中可能存在Na+、Ba2+、Cl- C、原溶液中一定不存在Ba2+、Fe3+、CO32- D、原溶液中可能存在Na+、Cl- -
6、甲~庚等元素在周期表中的相对位置如下表。己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
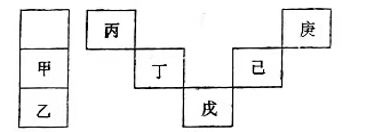 A、丙与戊的原子序数相差28 B、气态氢化物的稳定性:庚<己<戊 C、常温下,甲和乙的单质均能与水剧烈反应 D、丁的最高价氧化物可用于制造半导体材料
A、丙与戊的原子序数相差28 B、气态氢化物的稳定性:庚<己<戊 C、常温下,甲和乙的单质均能与水剧烈反应 D、丁的最高价氧化物可用于制造半导体材料 -
7、C4H8BrCl的同分异构体有( )A、9种 B、8种 C、12种 D、10种
-
8、CO2与SO2都是酸性氧化物,有许多相似的化学性质。用X表示C或S元素,下列反应的离子方程式一定正确的是( )A、使用过量的氨水吸收: B、将少量的XO2通入漂白粉溶液中: C、XO2溶于水: D、将过量的XO2通入NaOH溶液中:
-
9、二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与H2O2类似,熔点为193R,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥氯气通入熔融的硫中制得。下列有关说法正确的是( )A、S2Cl2是含有极性键和非极性键的非极性分子 B、固态时S2Cl2属于共价晶体 C、S2Cl2与NaOH的化学方程式可能为: D、S2Cl2的电子式为
-
10、设NA为阿伏加德罗常数的值,下列说法正确的是( )A、一定量的钠与8g氧气反应,若两者均无剩余,转移电子的数目为NA B、等物质的量的14NO和13CO气体中所含中子数均为15NA C、1mol丙烯酸(CH2=CHCOOH)中含有双键的数目为NA D、常温下,100mLpH=1的醋酸溶液中含有的氢离子数目为0.01NA
-
11、已知拆开1molH-H键,1molN=N键分别需要吸收的能量为436kJ、946kJ;形成1molN-H键,会放出能量391kJ,在反应中,每生成3molN-H键( )A、吸收92kJ热量 B、放出46kJ热量 C、放出209kJ热量 D、吸收209kJ热量
-
12、欲配制100mL1.0mol·L-1硫酸钠溶液,不正确的方法是( )A、将14.2g硫酸钠溶于100mL水中 B、将32.2gNa2SO4·10H2O溶于少量水中,再加水稀释至100mL C、将20mL5.0mol·L-1硫酸钠溶液用水稀释至100mL D、将14.2g硫酸钠溶于水中得到100mL溶液
-
13、化学与生活密切相关,下列说法正确的是( )A、氢氧化铝胶体可用来对自来水净化和杀菌消毒 B、“血液透析”利用了胶体丁达尔效应 C、BaSO4常用来作胃镜中的“钡餐” D、为了消除碘缺乏病,在食用盐中加入一定量的碘单质
-
14、某校化学兴趣小组学习了“氯气的实验室制法”后,利用如图所示实验装置对的制备及性质进行探究。回答下列问题:
 (1)、仪器a的名称为。(2)、实验室若选用固体和浓盐酸在常温条件下制取干燥的 , 则选用的发生装置为(填“A”或“B”)。(3)、装置C的主要作用为;装置D是用于干燥 , 故装置D中的试剂为(填化学式)。(4)、用装置E收集 , 进气口为(填“b”或“c”)。(5)、工业上一般将通入石灰乳中制取含氯漂白粉,同学们利用如图装置进行实验。
(1)、仪器a的名称为。(2)、实验室若选用固体和浓盐酸在常温条件下制取干燥的 , 则选用的发生装置为(填“A”或“B”)。(3)、装置C的主要作用为;装置D是用于干燥 , 故装置D中的试剂为(填化学式)。(4)、用装置E收集 , 进气口为(填“b”或“c”)。(5)、工业上一般将通入石灰乳中制取含氯漂白粉,同学们利用如图装置进行实验。
已知:①与潮湿的消石灰反应是放热反应;
②温度较高时,与潮湿的反应方程式为。
发现实验所得产率较低,可能的原因是。
-
15、钠是一种非常活泼、具有广泛应用的金属。回答下列问题:(1)、钠原子的结构示意图为 , 在化学反应中容易(填“得到”或“失去”)电子。(2)、钠的一种常见淡黄色氧化物,常用作呼吸面具的供氧剂。该物质与反应的化学反应方程式为。(3)、观察法也是学习化学的重要方法,金属钠放置在空气中观察到下列现象。
①反应I后固体变灰暗,该固体的化学式为 , 将少量灰暗色固体投入溶液中,观察到的实验现象为。
②反应II后得到的固体为NaOH,NaOH在水中的电离方程式为。
③下列属于白色晶体用途的是(填字母)。
A.制肥皂 B.造纸 C.烘焙蛋糕 D.用于治疗胃酸过多症
-
16、现有四种阳离子、、、和四种阴离子、、、可分别组成A、B、C、D四种易溶于水、易电离的物质(离子均不重复)。物质A、B、C、D有以下性质:
①溶液A能使紫色石蕊试液变红,且溶液中阴阳离子个数比为1:2;
②溶液B分别与A、C、D溶液混合,均有白色沉淀生成;
③溶液C能与溶液A反应产生无色无味气体。
已知:。
回答下列问题:
(1)、物质A的化学式为 , 物质B溶于水显性。(2)、溶液B与溶液C反应生成的白色沉淀为(填化学式,下同),溶液B与溶液D反应生成的白色沉淀为。(3)、验证溶液D中阴离子的方法为。(4)、溶液A与过量溶液B发生反应的化学方程式为。 -
17、氧化还原反应原理在研究物质性质及物质转化等方面具有重要的价值。回答下列问题:(1)、用惰性电极电解饱和食盐水可以得到NaOH、、 , 写出该反应的化学方程式:。(2)、亚硝酸钠具有致癌作用,许多腌制食品中含。酸性溶液与反应的化学方程式为 , 将它改写为离子方程式并用双线桥表示电子转移的方向和数目:。(3)、新储氢材料-碳纳米管可利用电弧法合成,合成过程中会伴随大量的碳纳米颗粒杂质,这种碳纳米颗粒杂质可用氧化气化法提纯,反应方程式为。
①该反应中,生成物X的化学式为;
②该反应中,氧化剂为(填化学式);
③该反应中,表现出(填字母);
A.酸性 B.还原性 C.氧化性
④该反应中,每生成3个 , 转移个电子。
-
18、氯在生产、生活中应用广泛,如图是部分含氯物质的价类二维图,下列说法正确的是( )
 A、新制的a溶液能使紫色石蕊试液褪色 B、物质c在光照条件下易分解 C、d能用于自来水消毒是因为具有强还原性 D、e的化学式一定是
A、新制的a溶液能使紫色石蕊试液褪色 B、物质c在光照条件下易分解 C、d能用于自来水消毒是因为具有强还原性 D、e的化学式一定是 -
19、下列除杂(括号内为杂质)选用的试剂或方法错误的是( )A、溶液:加入过量铁粉,过滤 B、NaCl溶液:加过量溶液后过滤 C、乙醇:向混合溶液中加生石灰,蒸馏 D、:通过盛有饱和溶液的洗气瓶
-
20、某兴趣小组的同学向一定体积的溶液中逐滴加入稀硫酸,并测得混合液的导电能力随时间变化曲线如图,该小组同学据图分析不正确的是( )
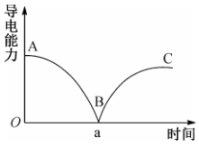 A、AB段溶液的导电能力不断减弱,说明溶液中离子浓度降低 B、B处的导电能力为0,说明溶液中几乎没有自由移动的离子 C、a时刻溶液中的与恰好完全沉淀 D、BC段溶液的导电能力不断增大,主要是由于属于电解质
A、AB段溶液的导电能力不断减弱,说明溶液中离子浓度降低 B、B处的导电能力为0,说明溶液中几乎没有自由移动的离子 C、a时刻溶液中的与恰好完全沉淀 D、BC段溶液的导电能力不断增大,主要是由于属于电解质