-
1、下列指定反应的离子方程式正确的是( )A、向硫酸氢钠溶液中滴加氢氧化钡溶液至刚好为中性: B、饱和滴入沸水中加热煮沸制备胶体:胶体 C、在强碱溶液中次氯酸钠与反应生成: D、向含有 的溶液中通入充分反应:
-
2、用新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图。下列说法正确的是( )
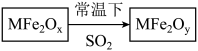 A、x﹥y B、SO2是该反应的催化剂 C、MFe2Ox是还原剂 D、SO2发生了分解反应
A、x﹥y B、SO2是该反应的催化剂 C、MFe2Ox是还原剂 D、SO2发生了分解反应 -
3、某兴趣小组用下列装置探究Na与CO2的反应产物,已知PdCl2+CO+H2O=Pd↓(黑色)+CO2+2HCl。下列说法正确的是( )
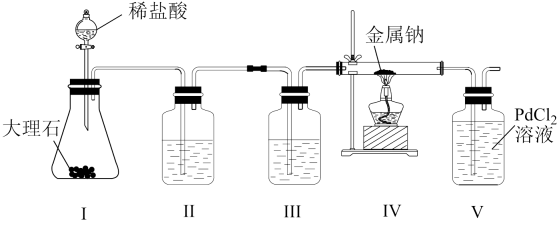 A、为了避免生成的CO2中混有HCl,最好用稀硫酸代替稀盐酸 B、装置III的目的是除去HCl C、实验时先点燃酒精灯,再打开活塞a D、装置V出现黑色沉淀,则装置IV发生反应可能为:2Na+2CO2=Na2CO3+CO
A、为了避免生成的CO2中混有HCl,最好用稀硫酸代替稀盐酸 B、装置III的目的是除去HCl C、实验时先点燃酒精灯,再打开活塞a D、装置V出现黑色沉淀,则装置IV发生反应可能为:2Na+2CO2=Na2CO3+CO -
4、标准状况下,V L中含有a个原子,则阿伏加德罗常数的值为( )A、 B、 C、 D、
-
5、将少量Na2O2分别放入盛有下列溶液的小烧杯中,最终会有白色沉淀产生的是( )
①MgSO4溶液②FeCl3溶液③Ca(HCO3)2溶液④饱和澄清石灰水
A、①③ B、①④ C、①③④ D、①②③④ -
6、下列说法正确的是( )A、Na2O、Na2O2的组成元素相同,二者分别与CO2反应的产物也相同 B、在反应2Na2O2+2H2O=4NaOH+O2↑中,Na2O2
 氧化剂,H2O是还原剂
C、Na2O2溶于水产生O2的离子方程式为Na2O2+H2O=2Na++2OH-+O2↑
D、Na2O2用作呼吸面具供氧剂时,一部分氧元素被氧化,另一部分氧元素被还原
氧化剂,H2O是还原剂
C、Na2O2溶于水产生O2的离子方程式为Na2O2+H2O=2Na++2OH-+O2↑
D、Na2O2用作呼吸面具供氧剂时,一部分氧元素被氧化,另一部分氧元素被还原
-
7、做焰色反应时,下列操作事项正确的是( )
①先把铂丝灼烧到与原来的火焰颜色相同,再蘸取被检物质
②钾的火焰颜色,要透过蓝色钴玻璃观察③每次实验后,要用盐酸把铂丝洗净
④最好选择火焰颜色较浅的煤气灯⑤也可以用光洁无锈的铁丝代替
A、仅④不正确 B、仅③不正确 C、仅②不正确 D、全部正确 -
8、NA代表阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,2.24 L N2和O2的混合气体中气体分子总数为0.2NA B、39 g Na2O2中含有的离子总数为1.5NA C、1 mol Cl2与足量的Fe反应,转移电子数为3NA D、1 mol OH-所含电子数为9NA
-
9、下列离子能大量共存的是( )A、使无色酚酞试液显红色的溶液中: B、无色透明的溶液中: C、含有大量的溶液中: D、使紫色石蕊试液呈红色的溶液中:
-
10、纳米材料是指在三维空间中至少有一维处于纳米尺寸(1~100nm)或由它们作为基本单元构成的材料。科学家曾研制出一种臂长7nm的不锈钢纳米镊子。若将很多这种镊子分散到水中,关于形成的体系说法正确的是( )A、这种不锈钢镊子很活泼,能够和水迅速反应 B、可以通过过滤的方法分离出镊子 C、用平行光照射,在侧面可以看见一条光亮的通路 D、静置后,镊子很快会沉到底部
-
11、下列分类正确的是( )
选项
单质
酸
碱
盐
胶体
A
水银
硝酸
纯碱
氯化钠
蛋白质溶液
B
银
磷酸
烧碱
火碱
烟
C
红磷
醋酸
熟石灰
胆矾
雾
D
臭氧
硫酸
氢氧化铜
氯化铵
氢氧化铁沉淀
A、A B、B C、C D、D -
12、辛勤劳动才能创造美好生活。如图所示劳动场景中,不涉及氧化还原反应的是( )
A
B
C
D




海水晒盐
冶炼钢铁
古法酿酒
用过氧乙酸消毒
A、A B、B C、C D、D -
13、已知:A是石油裂解气的主要产物之一,其产量常用于衡量一个国家的石油化工发展水平。下列是有机物A~G之间的转化关系:
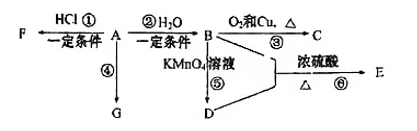
请回答下列问题:
(1)、A的官能团的名称是;C的结构简式是;G是一种高分子化合物,其最简式是。(2)、E是一种具有香味的液体,B+D→E的反应方程式为 , 该反应类型是;比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质F(沸点12.27℃)进行应急处理。写出由A制F的化学反应方程式;E的同分异构体能与NaHCO3溶液反应,写出该同分异构体的结构简式(一种即可)。 -
14、氧化铈(CeO2)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈,其工艺流程如图所示:
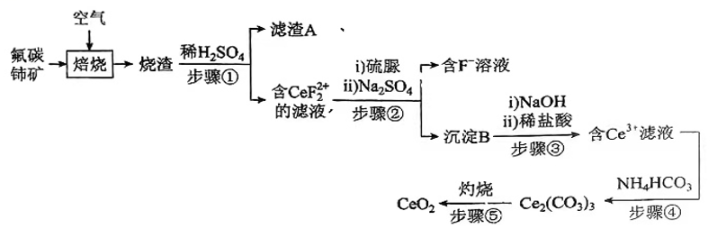
已知:①稀土离子易与SO42-形成复盐沉淀,Ce3+和SO42-发生反应:;
②硫脲:具有还原性,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+ , 两者均能形成氢氧化物沉淀;
④Ce2(CO3)3为白色粉末,难溶于水。
回答下列问题:
(1)、滤渣A的主要成分是(填写化学式)。(2)、在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质,请写出焙烧过程中相应的化学方程式。(3)、焙烧后加入稀硫酸浸出,为提高Ce的浸出率,需控制硫酸浓度不能太大的原因是。(4)、加入硫脲的目的是将CeF22+还原为Ce3+ , 反应的离子方程式为。(5)、步骤③加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为。(6)、下列关于步骤④的说法正确的是____(填字母)。A、该步骤发生的反应是 B、可以用Na2CO3溶液代替NH4HCO3溶液,不影响产品纯度 C、过滤时选择减压过滤能够大大提高过滤效率 D、过滤后的滤液中仍含有较多Ce3+ , 需要将滤液循环以提高产率(7)、取所得产品7.00gCeO2溶解后配成250mL溶液。取25.00mL该溶液用0.20mol.L-1硫酸亚铁铵【(NH4)2Fe(SO4)2】溶液滴定,滴定时发生反应 , 达到滴定终点时消耗硫酸亚铁铵溶液18.50mL,则该产品的纯度为。(保留三位有效数字)。 -
15、四氯化锡(SnCl4)是一种重要的化工原料,主要用于有机锡化合物的制造,也可用作分析试剂、有机合成脱水剂等。已知锡单质在加热时可直接与氯气化合生成,某实验小组用如下装置对其进行合成。
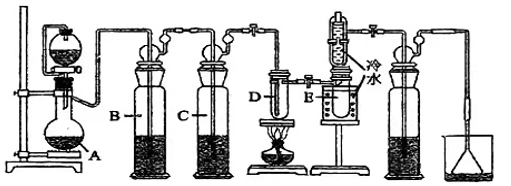
【相关药品性质】
药品
颜色、状态
熔点(℃)
沸点(℃)
其他性质
Sn
银白色固体
231
2260
较活泼金属能与O2、HCl等气体发生反应
SnCl4
无色液体
-33
114
极易水解产生SnO2.xH2O溶胶
请回答下列问题:
(1)、仪器A的名称是。(2)、写出SnCl4水解的化学方程式。将少量SnCl4置于空气中可观察到的现象是。(3)、检验装置气密性后,向A中装入KMnO4固体,小试管D内装入Sn片,恒压滴液漏斗中加入浓盐酸,(填“操作”及“现象”),点燃酒精灯开始反应;(4)、若无洗气瓶B,可能会导致的问题是;洗气瓶C中所盛放的药品是。(5)、试验结束后,小试管E内收集到的液体呈淡黄色,其原因是。 -
16、(1)、(I)工业合成氨的反应:是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1molH一H、1molN一H、1mol放出的能量分别为436kJ、391kJ、946kJ。则:
工业上合成2molNH3共放出能量kJ;实验室模拟工业合成氨时,在容积为2L的密闭容器内,开始投入N220mol、H230mol,反应经过10min后,生成10 mol NH3 , 则用N2表示的化学反应速率是mol·L-1·min-1。(2)、如果将1molN2和3molH2混合,使之充分反应,反应放出的热量总小于上述数值,为什么?。(3)、(Ⅱ)某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案,已知:实验
0.1 mol.L-1酸性KMnO4溶液的体积/mL
0.6mol.L-1H2C2O4溶液的体积/mL
H2O的体积/mL
实验温度/℃
溶液褪色所需时间/min
1
10
V1
35
25
②
10
10
30
25
③
10
10
V2
50
表中V1=mL。
探究温度对化学反应速率影响的实验编号是(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是。
实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=mol·L-1·min-1。
-
17、某种固体消毒剂广泛用于游泳池消毒,其结构如图所示,其中W、X、Y、7是原子序数依次增大的四种短周期元素,Y的最外层电子数是内层电子数的3倍。下列叙述错误的是( )
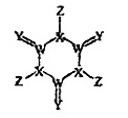 A、W和Z组成的化合物可以作灭火剂 B、原子半径:W>X>Y C、氧化物对应的水化物的酸性:Z>X D、该化合物中X、Y、Z均满足8电子稳定结构
A、W和Z组成的化合物可以作灭火剂 B、原子半径:W>X>Y C、氧化物对应的水化物的酸性:Z>X D、该化合物中X、Y、Z均满足8电子稳定结构 -
18、某化工厂制备净水剂硫酸铁铵晶体【NH4Fe(SO4)2·6H2O】的一种方案如下:

下列说法不正确的是( )
A、滤渣A的主要成分是CaSO4 B、“合成”反应要控制温度,温度过高,产率会降低 C、“系列操作”包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等 D、相同条件下,NH4Fe(SO4)2·6H2O净水能力比FeCl3强 -
19、已知:溴化铁在200℃以上易分解,煮沸水溶液也会使其分解,生成溴化亚铁和溴单质。实验室里利用如图装置制取纯净的无水FeBr3。
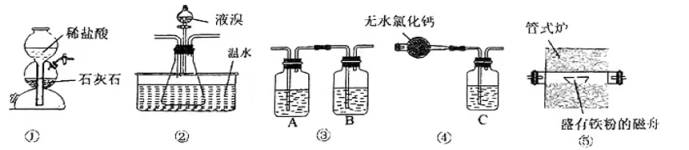
下列说法正确的是( )
A、A、B、C分别盛有饱和Na2CO3溶液、浓硫酸和烧碱溶液 B、实验结束时,先停止加热并停止滴入液溴,继续通入CO2至室温 C、实验开始时,先加热管式炉,再打开装置①中活塞 D、装置②中温水的作用是降低装置①中生成的CO2在液溴中的溶解度 -
20、将0.1molCl2通入100mL含等物质的量的HBr与H2SO3的混合溶液中,有一半的HBr被氧化,则下列说法正确的是( )A、物质的还原性:HBr>H2SO3>HCl B、HBr与H2SO3的物质的量浓度均为0.6mol·L-1 C、通入0.1molCl2发生反应的离子方程式为 D、若再通入0.05molCl2 , 恰好能将HBr和H2SO3完全氧化