-
1、钛(Ti)和锆(Zr)是同一副族的相邻元素,它们的化合物在生产、生活中有着广泛的用途。回答下列问题:(1)、钛和锆的价层电子结构相似,基态锆原子的价电子排布式为。(2)、Ti(BH4)2是一种储氢材料。BH4- 的空间构型是 , H、B、Ti的电负性由大到小的顺序为。(3)、ZrCl4可以与乙二胺形成配合物[ZrCl4(H2NCH2CH2NH2)],其中Zr原子配位数为6。
①1mol [ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为mol。
②H2NCH2CH2NH2形成[ZrCl4(H2NCH2CH2NH2)]后,H-N-H键角将(填“变大”“变小”或“不变”),原因是。
(4)、已知TiO2晶胞中Ti4+位于O2−所构成的正八面体的体心,ZrO2晶胞中Zr4+位于O2−所构成的立方体的体心,其晶胞结构如图所示:
①TiO2晶胞中O2−的配位数是。
②已知ZrO2晶胞的密度为ρ g·cm−3 , 则晶体中Zr原子和O原子之间的最短距离pm(列出表达式,NA为阿伏加德罗常数的值,ZrO2的摩尔质量为M g/mol)。
-
2、一种“氢氧化锶-氯化镁法”制备“牙膏用氯化锶(SrCl2·6H2O)”的工艺流程如下:
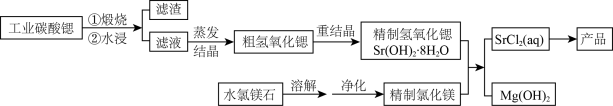 (1)、锶与钙元素同主族。金属锶应保存在中(填“水”、“乙醇”或“煤油”)。(2)、天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为。(3)、工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质。“滤渣”的主要成分是。(4)、“重结晶”时蒸馏水用量(以质量比mH2O:mSrO表示)对Sr(OH)2·8H2O纯度及产率的影响如下表。最合适的质量比为 , 当质量比大于该比值时,Sr(OH)2·8H2O产率减小,其原因是。
(1)、锶与钙元素同主族。金属锶应保存在中(填“水”、“乙醇”或“煤油”)。(2)、天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为。(3)、工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质。“滤渣”的主要成分是。(4)、“重结晶”时蒸馏水用量(以质量比mH2O:mSrO表示)对Sr(OH)2·8H2O纯度及产率的影响如下表。最合适的质量比为 , 当质量比大于该比值时,Sr(OH)2·8H2O产率减小,其原因是。质量mH2O:mSrO
4:1
5:1
6:1
7:1
8:1
9:1
10:1
Sr(OH)2·8H2O纯度%
98.64
98.68
98.65
98.64
98.63
98.63
98.65
Sr(OH)2·8H2O产率%
17.91
53.36
63.50
72.66
92.17
89.65
88.93
(5)、水氯镁石是盐湖提钾后的副产品,其中SO42-含量约为1%,“净化”过程中常使用SrCl2除杂,写出该过程的离子方程式。(6)、将精制氢氧化锶完全溶于水,与氯化镁溶液在90℃时反应一段时间,下列判断MgCl2是否反应完全的最简易可行的方法是____(填标号)。A、反应器中沉淀量不再增加 B、测定不同时间反应液pH C、测定Sr2+浓度变化 D、向反应器中滴加AgNO3溶液观察是否有沉淀(7)、若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为。 -
3、某学习小组为了验证SO2的还原性并测定产生SO2的质量,组装了下图装置。回答下列问题:(已知:K3[Fe(CN)6]可检验亚铁离子,生成蓝色沉淀)
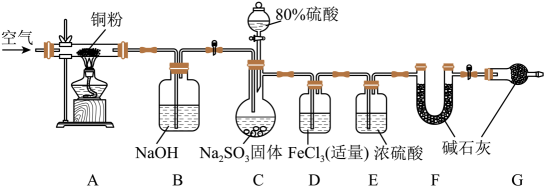 (1)、C中发生反应的化学方程式是 , 关于该套装置说法正确的是(填标号)。
(1)、C中发生反应的化学方程式是 , 关于该套装置说法正确的是(填标号)。a.组装仪器、加入药品后检查气密性
b.实验开始和最后时均需要通入空气
c.利用A、B装置是为了减小实验误差
d.F、G中的碱石灰可以换为无水CaCl2
(2)、甲同学认为很快可以看到D装置的现象,他的依据是(用离子方程式表示)。乙同学做实验时发现和甲同学预测的现象不一样,先出现棕红色,经过一段时间后变为浅绿色。于是查阅资料发现反应分为两步:第一步:Fe3++SO2+H2O = Fe(HSO3)2+(棕红色)+H+ (快反应)
第二步:Fe3++ Fe(HSO3)2+ +H2O=SO42-+2Fe2++3H+ (慢反应)
如果需要验证第一步反应是快反应,可以事先在D装置中滴加数滴试剂,相应的实验现象是。
(3)、学习小组通过实验后D和F装置中的数据来计算SO2的质量。D中加入足量的BaCl2溶液充分反应,经过操作,测得沉淀为m1g,F的质量差为m2g,C中产生SO2的体积(标准状况下)为L。 -
4、固体化合物X由四种元素组成,某学习小组开展如下探究实验。下列说法错误的是
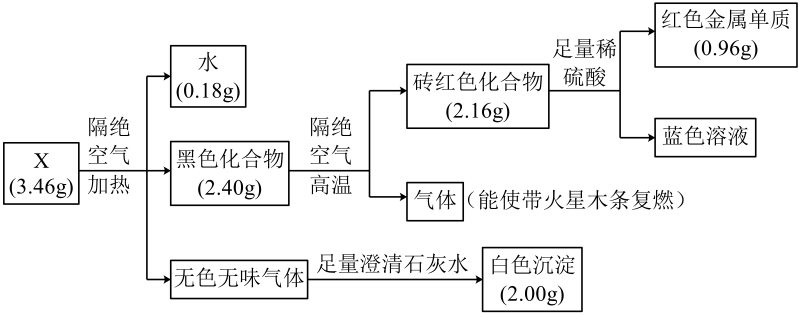 A、固体化合物X中的金属元素位于周期表第四周期第ⅠB族 B、固体化合物X为Cu2(OH)2CO3 C、黑色化合物隔绝空气分解的过程中,生成1 mol砖红色化合物,转移2 mol电子 D、蓝色溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可制得胆矾晶体
A、固体化合物X中的金属元素位于周期表第四周期第ⅠB族 B、固体化合物X为Cu2(OH)2CO3 C、黑色化合物隔绝空气分解的过程中,生成1 mol砖红色化合物,转移2 mol电子 D、蓝色溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可制得胆矾晶体 -
5、“肼合成酶”以其中的Fe2+配合物为催化中心,可将NH2OH与NH3转化为肼(NH2NH2),其反应历程如图所示。
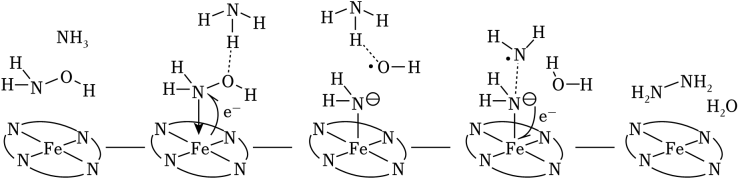
下列说法错误的是( )
A、NH2OH、NH3和H2O均为极性分子 B、反应涉及N﹣H、N﹣O键断裂和N﹣N键生成 C、催化中心的Fe2+被氧化为Fe3+ , 后又被还原为Fe2+ D、将NH2OH替换为ND2OD,反应可得ND2ND2 -
6、W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,Z2是氧化性最强的单质,4种元素可形成离子化合物(XY)+ (WZ4)- 。下列说法正确的是( )A、分子的极性:WZ3<XZ3 B、第一电离能:X<Y<Z C、氧化性:X2Y3<W2Y3 D、键能:X2<Y2<Z2
-
7、冠醚因分子结构形如皇冠而得名,某冠醚分子c可识别K+ , 其合成方法如图。下列说法错误的是( )
 A、该反应为取代反应 B、a、b均可与NaOH溶液反应 C、c核磁共振氢谱有3组峰 D、c可增加KI在苯中的溶解度
A、该反应为取代反应 B、a、b均可与NaOH溶液反应 C、c核磁共振氢谱有3组峰 D、c可增加KI在苯中的溶解度 -
8、工业上联合生产碳酸氢钠和氯代烃的工艺流程如图所示,在生产NaHCO3的过程中完成乙烯氯化,下列叙述错误的是( )
 A、过程I中的TBA替代了侯德榜制碱法中的氨气 B、在过程Ⅱ中实现了TBA、CuCl2的再生 C、理论上每生成1molNaHCO3 , 可得到1molC2H4Cl2 D、过程Ⅲ中的反应是
A、过程I中的TBA替代了侯德榜制碱法中的氨气 B、在过程Ⅱ中实现了TBA、CuCl2的再生 C、理论上每生成1molNaHCO3 , 可得到1molC2H4Cl2 D、过程Ⅲ中的反应是 -
9、设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、3.6 g D2O和3.6 g H2O中含有的质子数均为2NA B、含 2 mol H2SO4的浓硫酸和足量Cu在加热的条件下反应可生成NA个SO2分子 C、常温常压下,22.4 L甲醛(HCHO)含有的原子数目为 4NA D、过氧化钠与水反应时,生成0.1 mol 氧气转移的电子数为 0.2NA
-
10、向饱和氯水中加入少量Na2SO3固体,下列说法正确的是( )A、溶液颜色变深 B、溶液pH减小 C、溶液漂白性增强 D、溶液导电性减弱
-
11、(1)、Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:

已知NaHCO3在低温下溶解度较小。
反应Ⅰ的化学方程式为。(2)、Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中 Na2CO3的含量。
检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若 , 说明装置不漏气。
(3)、装置A中的试剂为 , 装置C中的试剂为。装置E的作用是。(4)、实验前称取28.80 g样品,实验后测得D装置增重8.80 g,则样品中Na2CO3的质量分数为(保留一位小数);若缺少E装置,会使测定结果(填“偏高”或“偏低”)。 -
12、甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、CO32-、SO42-中的不同阳、阴离子各一种组成已知:
①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;
②0.1mol/L乙溶液中c(H+)>0.1mol/L;
③向丙容器中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。
(1)、甲是 , 乙是 , 丙是 , 丁是。(2)、50mL含Na2SO4、Na2CO3的混合溶液中加入过量的甲溶液,得到14.51g白色沉淀,向白色沉淀中加入过量的稀HNO3充分反应后,沉淀减少到4.66g,并有气体产生。①写出产生气体的离子方程式:;
②混合溶液中Na+的物质的量的浓度是。
-
13、用98%的浓硫酸(ρ=1.84g⋅cm-3)配制1mol·L-1稀硫酸480mL。(1)、实验中应选用的玻璃仪器除了量筒、烧杯、玻璃棒外还只需要(填仪器名称)。(2)、实验操作:
a.用量筒量取98%的浓硫酸;
b.将稀释后的浓硫酸转移到容量瓶中;
c.用少量蒸馏水洗涤小烧杯和玻璃棒2~3次,并将洗涤液转移到容量瓶中;
d.在小烧杯内稀释浓硫酸稀释时要用玻璃棒不断搅拌;
e.向容量瓶中直接加蒸馏水至距离刻度线1~2cm处;
f.盖上容量瓶瓶塞,摇匀,装瓶,贴标签;
g.用胶头滴管小心加蒸馏水至刻度线。
实验分析:
①步骤a中应该取浓硫酸mL。
②正确的操作顺序是(填序号)。
③下列操作使所配溶液的浓度偏高的有(填字母)。
A.使用容量瓶配制溶液时,俯视刻度线定容
B.取用敞口放置过长时间的浓硫酸
C.容量瓶用蒸馏水洗净后还剩有少量水
D.量取浓硫酸的量筒用蒸馏水洗涤两次并将洗涤液转入容量瓶
E.量取浓硫酸时俯视刻度线
-
14、某化学兴趣小组在实验室用如下装置制备氯气:

请回答下列问题:
(1)、装置A中发生反应的化学方程式为。(2)、若要制备纯净、干燥的氯气,需在A、B之间添加净化装置D、E,其中导管连接的顺序是(填写数字编号)。(3)、D装置的作用是;E装置的作用是。(4)、C装置中发生反应的离子方程式为。 -
15、回答下列问题:(1)、用20 g NaOH 配制成500 mL溶液,其物质的量浓度为mol/L,从中取出1 mL,其物质的量浓度为mol/L,含溶质g。若将这1 mL溶液用水稀释到100 mL,所得溶液中溶质的物质的量浓度为moI/L。(2)、在一定温度和压强下,0.4 mol某气体的体积为9.8 L,则该条件下的气体摩尔体积为。(3)、有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为。(4)、标准状况下,1.7g NH3与LH2S气体含有的氢原子数相同。
-
16、利用锥形瓶及CO2传感器测定密闭装置中的分压,采集数据如下:

实验a:在锥形瓶内装入饱和溶液,加热,数据显示为图①;实验b:在锥形瓶内加入少量蒸馏水,加入固体后可形成饱和溶液,数据显示为图②。下列叙述不正确的是( )
A、实验a,溶液温度在50℃之前,溶液温度升高使CO2分压增大 B、实验a,温度升高到50℃之后,NaHCO3分解生成CO2使分压增大 C、实验b,NaHCO3与CaCl2反应为:2NaHCO3+CaCl2=Ca(HCO3)2+2NaCl D、实验b,CO2分压增大,发生反应离子方程式为:Ca2++2=CaCO3↓+CO2↑+H2O -
17、同温同压下,用两个体积均为1L的圆底烧瓶分别收集HCl,将两烧瓶倒立在水槽中,a烧瓶内迅速充满水,b烧瓶内水充满 , 溶质均未向水槽内扩散,所得盐酸的物质的量浓度分别记为a和b(单位mol/L),则a、b关系为( )A、a>b B、a=b C、a<b D、不能确定
-
18、用作食盐中的补碘剂,具有氧化性,可用“氯酸钾氧化法”制备,该方法的第一步反应为。下列说法正确的是( )A、产生22.4L(标准状况)时,反应中转移 B、反应中氧化剂和还原剂的物质的量之比为6:11 C、可用石灰水吸收反应产生的制备漂白粉 D、能在酸性条件下氧化 , 因此可用酸化的淀粉碘化钾溶液检验食盐中的存在
-
19、向NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图所示。下列判断正确的是( )
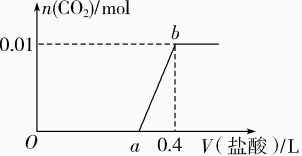 A、Oa段只发生中和反应 B、ab段发生反应的离子方程式为:HCO+H+=CO2↑+H2O C、a=0.2 D、原混合溶液中NaOH与Na2CO3的物质的量之比为 1∶2
A、Oa段只发生中和反应 B、ab段发生反应的离子方程式为:HCO+H+=CO2↑+H2O C、a=0.2 D、原混合溶液中NaOH与Na2CO3的物质的量之比为 1∶2 -
20、向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示。则下列说法中不正确的是(已知:还原性:I->Fe2+>Br-)( )
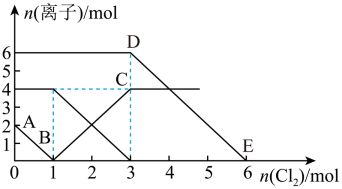 A、DE线段的反应方程式:2Br-+Cl2=Br2+2Cl- B、原混合溶液中FeBr2的物质的量为3mol C、线段AB表示Fe2+被氯气氧化 D、原溶液中:n(Fe2+):n (I-):n (Br-)=2:1:3
A、DE线段的反应方程式:2Br-+Cl2=Br2+2Cl- B、原混合溶液中FeBr2的物质的量为3mol C、线段AB表示Fe2+被氯气氧化 D、原溶液中:n(Fe2+):n (I-):n (Br-)=2:1:3