-
1、已知: , 在一容积可变的密闭容器中进行,下列条件的改变能使上述反应速率加快的是( )
①将容器的容积缩小一半
②增加铁粉的质量
③保持容器容积不变,充入N2使体系压强增大
④保持容器容积不变,充入水蒸气使体系压强增大
A、①④ B、②③ C、①③ D、②④ -
2、对于可逆反应 , 在不同条件下的化学反应速率如下,其中表示的反应速率最大的是( )A、 B、 C、 D、
-
3、下列有关反应速率的说法中正确的是( )A、合成氨工业中使用合适催化剂可以提高反应速率以及增大该反应的限度 B、等质量的锌粉和锌片与相同体积、相向浓度的盐酸反应,反应速率相等 C、用铁片与硫酸制备氢气时,浓硫酸可以加快产生氢气的速率 D、已知二氧化硫催化氧化反应的△H<0,则升高温度,反应速率增大
-
4、化学与生产、生活和社会发展密切相关,下列叙述正确的是( )A、华为5G手机麒麟9000芯片(HUAWEIKirin)主要成分是二氧化硅 B、“酒曲”的酿酒工艺,是利用了催化剂使平衡正向移动的原理 C、免洗洗手液的有效成分之一活性银离子能使病毒蛋白质变性 D、葛洪所著《抱朴子》中“丹砂(HgS)烧之成水银,积变又还原成丹砂”,二者为可逆反应
-
5、碳酸钠在工业上有广泛的应用,碳酸氢钠是常用的发酵剂的主要成分。回答下列问题:
a.1861年比利时人索尔维以食盐、石灰石和氨为原料制得了碳酸钠,这种方法叫做氨碱法,也叫索尔维制碱法,其工艺流程如图所示。
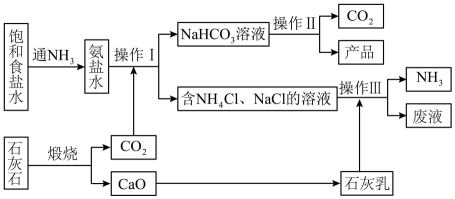 (1)、向氨盐水中通入时,反应的化学方程式为。(2)、操作III中发生反应的离子方程式为。(3)、废液中含有的两种主要溶质是(填化学式)。(4)、b.我国化学家侯德榜改革国外的纯碱生产工艺,将氨与纯碱的生产联合起来,称为联合制碱法,生产流程可简要表示为下图所示:
(1)、向氨盐水中通入时,反应的化学方程式为。(2)、操作III中发生反应的离子方程式为。(3)、废液中含有的两种主要溶质是(填化学式)。(4)、b.我国化学家侯德榜改革国外的纯碱生产工艺,将氨与纯碱的生产联合起来,称为联合制碱法,生产流程可简要表示为下图所示:
煅烧炉中发生反应的化学方程式为 , 从母液中提取的副产品为(填化学式)。
(5)、为检验产品碳酸钠中是否含有少量的氯化钠杂质,可以采用以下方法:取少量试样溶于水中, (写出操作、现象与结论)。c.内蒙古高原天然碱湖主要分布在鄂尔多斯盆地北部、二连盆地中部、巴丹吉林沙漠和海拉尔盆地东南部。面积一般为数平方公里至数十平方公里,多被沙丘所环绕。
(6)、从碱湖中提取的某物质化学组成为x Na2CO3・y NaHCO3・z H2O(x、y、z为互素的正整数),为了确定其成分,称取天然碱样品7.3g,充分加热后得到水的质量为0.9g,二氧化碳的质量为1.1g。该天然碱的化学式为。 -
6、强氧化剂一般用来进行消毒、漂白等工序。回答下列问题:(1)、臭氧可以通过氧气在放电条件下生成,上述两种单质都是氧元素的。(2)、1984年,北京第一传染病医院研制成功能迅速杀灭各类肝炎病毒的消毒液,后更名为“84消毒液”。该消毒液可用氯气与氢氧化钠溶液在常温下反应制得,发生反应的离子方程式为。如果在某次反应中,有个氯气分子参与此反应,则过程中转移的电子数为。(3)、漂粉精中的有效成分为 , 其进行焰色试验的特征颜色为(填标号)。
a.黄色b.砖红色c.绿色d.紫红色
(4)、新型的消毒剂在中性溶液中可将剧毒的氧化为两种无毒的气体,自身被还原为 , 则发生反应的离子方程式为;“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是“分别在氧化还原反应中得到等量的电子时,与该种含氯消毒剂的质量比”,则的有效氯含量为(结果保留两位小数)。 -
7、在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验所用的仪器如下:
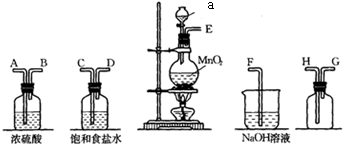
回答下列问题:
(1)、仪器a的名称为。(2)、连接上述装置的正确顺序是:。(3)、气体发生装置中进行的反应化学方程式是;若收集到的氯气的质量为7.1 g,则被氧化的的质量是。(4)、饱和食盐水的作用为。(5)、将足量氯气缓慢通入紫色石蕊溶液中,现象为。(6)、常温下使用高锰酸钾与浓盐酸也可以制氯气,且锰元素在反应中全部转化为 , 反应的化学方程式为。 -
8、在化学活动周中,某校兴趣小组的同学在老师指导下探究铁元素相关物质的性质。回答下列问题:(1)、实验室现有一瓶饱和溶液,甲同学向沸水中逐滴加入饱和溶液,煮沸至液体呈红褐色,停止加热,写出此过程中的离子方程式。为了证明制得的红褐色液体属于胶体,可以使用的方法是;乙同学将少量钠单质投入氯化铁溶液中制得铁单质,请评价这一实验方案的可行性(若可行,请写出发生反应的离子方程式,若不可行,请说明理由)。(2)、丙同学意图用干燥、纯净的一氧化碳还原氧化铁。实验装置如图,其中装置是实验室用草酸和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:。

①装置B中盛放的药品为 , 装置D的作用为。
②在实验开始前,应先打开装置(选填“A”或“E”)中的加热装置。写出装置中发生反应的化学方程式并用双线桥法标出电子转移 , 其中氧化产物与还原产物的质量比为。
③该装置的主要缺陷是。
-
9、将与按一定比例混合后在密闭容器中加热充分反应,冷却到室温,最终得到了。经检验容器内无、和存在,下列说法错误的是( )A、产物中一定含有NaOH B、与的质量比为 C、在反应中既作氧化剂又作还原剂 D、由过氧化钠转化得到的碳酸钠的质量为106 g
-
10、加热条件下,将通入溶液中,反应得到、、的混合液,经测定溶液中和的个数之比为1:2,则与溶液反应时被还原的氯元素原子与被氧化的氯元素原子的个数之比为( )A、11:3 B、21:5 C、3:1 D、4:l
-
11、向一定量的MnSO4溶液中依次加入下列溶液,对应的实验现象如下表所示,根据实验现象推测KMnO4、H2O2、Na2S2O8、I₂的氧化性由弱到强的顺序为( )
加入溶液
①适量Na2S2O8溶液
②过量H2O2
③适量淀粉-KI溶液
实验现象
溶液由无色变为紫色
紫色消失,产生气泡
溶液变蓝
注:实验中“适量”指二者恰好完全反应。
A、I2 , H2O2 , KMnO4 , Na2S2O8 B、I2 , KMnO4 , H2O2 , Na2S2O8 C、Na2S2O8 , KMnO4 , I2 , H2O2 D、Na2S2O8、H2O2、4 , I2 -
12、下列物质间的转化能通过一步反应实现的有( )
① ② ③ ④
A、1个 B、2个 C、3个 D、4个 -
13、下列离子方程式中正确的是( )A、铜片插入硫酸锌溶液中: B、钠与水的反应: C、用食醋除水垢的反应: D、溶液与少量溶液反应:
-
14、某化学研究小组对某无色水样的成分进行检验,已知该水样中只可能含有、、、、、、、、中的若干种离子。该小组同学取部分水样进行实验。
①向水样中先滴加足量硝酸钡溶液,产生白色沉淀;
②再滴加足量稀盐酸,沉淀部分溶解;
③最后滴加硝酸银溶液,又产生白色沉淀。
则下列说法错误的是( )
A、溶液中一定有 B、溶液中一定有 C、溶液中一定有 D、溶液中一定有 -
15、实验小组的同学使用如图装置(搅拌装置略)将试剂a逐渐滴加到试剂b中,探究溶液离子浓度变化,灯光变化可能出现 “亮→暗(或灭)→亮”现象的是( )
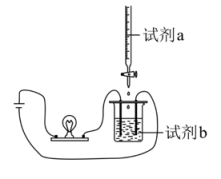
选项
试剂a
试剂b
A
HCl
Ca(OH)2
B
H2SO4
NaOH
C
Na2SO4
Ba(OH)2
D
H2SO4
Ba(OH)2
A、A B、B C、C D、D -
16、绿色化学又称环境友好化学,其宗旨是通过化学方法在生产过程中减少有害物质的使用和产生,从源头上降低或消除污染,下列行为不属于绿色化学的是( )A、使用低毒性的电镀稳定剂来取代剧毒的 B、在街道两侧规模种植某种可大量吸收的植物 C、寻找高效工业催化剂加快生产,减少需要的能耗 D、研发可回收、可被微生物分解的新型塑料
-
17、下列离子可以在水溶液中大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、
-
18、根据特征对物质进行分类是一种重要的科学方法,下列说法中错误的是( )A、盐酸、氯水都是溶液,云、雾、有色玻璃都是胶体 B、金属氧化物不一定都是碱性氧化物,所有非金属氧化物都是酸性氧化物 C、燃料电池使用的氢氧化钾、甲烷、空气依次属于碱、有机物、混合物 D、氯化钠、硫酸钡、水都是电解质,二氧化碳、葡萄糖都不是电解质
-
19、下列关于金属元素焰色试验的说法中错误的是( )A、只有金属元素的单质可以进行焰色试验 B、部分金属单质在灼烧时可以产生特定的焰色 C、实验室无铂丝时可以用洁净的铁丝代替 D、钾元素的焰色试验中需要用到蓝色钴玻璃
-
20、下列物质与其用途对应错误的是( )A、煤油——保存钠单质 B、氢氧化钠——治疗胃酸过多 C、酒精——杀菌消毒 D、活性炭——吸附水中杂质