-
1、氮及其化合物转化具有重要应用。下列说法正确的是( )A、工业制硝酸过程中的物质转化: B、人工固氮制备尿素的物质转化: C、用溶液吸收含有尾气: D、向溶液中加入过量的溶液并加热:
-
2、阅读下列材料,完成问题:
周期表中ⅥA族元素及其化合物应用广泛。氧元素常见单质有和 , 在氧气中燃烧的燃烧热为 , 可将转化为和;硫的常见氧化物为和 , 可做漂白剂;亚硫酰氯()为黄色液体,遇水发生水解;Se是不溶于水的半导体材料,可通过还原()制备;工业上可电解与混合溶液制备过二硫酸铵 , 过二硫酸铵与双氧水中都含有过氧键()。
(1)、下列说法不正确的是( )A、的键角为120° B、的空间结构为正四面体形 C、、、互为同位素 D、分子中的化学键均为极性共价键(2)、下列化学反应表示正确的是( )A、的燃烧: B、亚硫酰氯水解的反应方程式: C、还原水溶液中的: D、电解法备时的阳极反应:(3)、下列关于物质的性质与用途具有对应关系的是( )A、浓硫酸具有脱水性,可用于干燥氯气 B、具有还原性,用于纸张的脱色增白 C、具有强氧化性,用于除去废水中 D、Se单质不溶于水,用于制作半导体光电材料 -
3、H、Li、Na、K位于周期表中ⅠA族。下列说法正确的是( )A、离子半径大小: B、电负性大小: C、第一电离能: D、碱性强弱:
-
4、实验室进行制备和性质探究,下列实验原理和装置不能达到实验目的的是( )
 A、制备 B、探究溶解性 C、探究氧化性 D、吸收尾气
A、制备 B、探究溶解性 C、探究氧化性 D、吸收尾气 -
5、反应可用于制备火箭推进剂。下列说法正确的是( )A、的球棍模型为
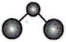 B、分子间可形成氢键
C、的电子式:
D、分子中含有键
B、分子间可形成氢键
C、的电子式:
D、分子中含有键
-
6、下列物品为江苏各地特产,其主要化学成分不能与其他三种归为一类的是( )A、东海水晶 B、宜兴紫砂壶 C、苏州丝绸 D、扬中玉雕
-
7、弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。根据要求回答问题。(1)、生活中明矾常作净水剂,其净水的原理是(用离子方程式表示)。(2)、常温下,取0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则pH=13的MOH溶液的浓度0.1mol/L(填“<”、“>”或“=”)。(3)、25℃时,三种酸的电离平衡常数如下:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
Ka =1.8×10-5
3.0×10-8
回答下列问题:
①25℃时,等浓度的三种溶液,酸性最强的是(填化学式),一般情况下,当温度升高时, (填“增大”、“减小”或“不变”);
②用蒸馏水稀释的醋酸,下列各式表示的数值随水量的增加而增大的是 (填序号)。
A. B. C. D.
③室温下,某溶液中存在着 CH3COOH(aq)+ (aq)CH3COO-(aq)+H2CO3(aq),该反应的平衡常数K=。(用Ka、K1或K2表示)
-
8、如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
 (1)、仪器A的名称是。(2)、盐酸的体积读数:滴定前读数为mL,滴定后读数为mL。(3)、某实验小组同学的三次实验的实验数据如表所示。根据表中数据计算出的待测NaOH溶液的平均浓度是mol/L。(保留四位有效数字)
(1)、仪器A的名称是。(2)、盐酸的体积读数:滴定前读数为mL,滴定后读数为mL。(3)、某实验小组同学的三次实验的实验数据如表所示。根据表中数据计算出的待测NaOH溶液的平均浓度是mol/L。(保留四位有效数字)实验序
待测NaOH溶液的体积
0.1000mol•L-1HCl溶液的体积/mL
号
/mL
滴定前刻度
滴定后刻度
1
25.00
0.00
26.11
2
25.00
1.56
31.30
3
25.00
0.22
26.31
(4)、滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):A.用碱式滴定管向锥形瓶里注入25.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)。
(5)、判断到达滴定终点的实验现象是:。(6)、下列哪些操作会使测定结果偏高(填序号)____。A、锥形瓶用蒸馏水洗净后,直接注入待测溶液进行滴定 B、滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 C、滴定前平视滴定管读数,滴定后俯视滴定管读数 D、酸式滴定管在滴定前有气泡,滴定后气泡消失 -
9、化学使我们的生活丰富多彩,在过去的100多年中,科学家合成和分离了近2300万种物质,满足了人类生存和社会进步的物质需求。现有下列物质:
①NaOH溶液 ②浓硫酸 ③氨水 ④冰醋酸 ⑤SO2 ⑥CaCO3 ⑦冰 ⑧石墨 ⑨蔗糖
回答下列问题:
(1)、以上物质中属于弱电解质的有(填序号,下同),属于非电解质的有。(2)、将②与⑨混合,可观察到混合物变黑,体积迅速膨胀,产生刺激性气味。该刺激性气味气体为 , 该过程体现物质②的性质有(答出两条即可)。(3)、室温下,向0.1mol•L-1③中不断加水,随着加水量的增加而减小的是(填字母)。a.c(OH-) b.c(H+)•c(OH-) c. d.
(4)、室温下,用0.100mol•L-1①滴定20mL0.100mol•L-1④的溶液,溶液pH随①体积的变化如图所示。
①醋酸的电离常数Ka(CH3COOH)≈(已知:lg2=0.3)。
②a、b、c三点溶液中,水的电离程度由大到小的顺序为。
-
10、已知A(g)+B(g)⇌C(g)+D(g)反应的平衡常数和温度的关系如下,回答下列问题:
温度/℃
700
800
900
1000
1200
平衡常数
0.5
0.6
1.0
1.6
2.0
(1)、该反应的ΔH 0(填“<”“>”“=”);(2)、900℃时,向一个固定容器为2L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始到2s内A浓度变化0.05mol•L-1 , 则A的平均反应速率v(A)= 。该反应达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为 (填“变大”、“变小”或“不变”)。(3)、判断反应是否达到平衡的依据为 ____ (填字母代号)。A、压强不随时间改变 B、气体的密度不随时间改变 C、c(A)不随时间改变 D、单位时间里生成C和D的物质的量相等(4)、1200℃时,若向另一相同容器中充入0.30molA、0.40mol B、0.40mol C和0.50molD,此时v正 v逆(填”大于“、”小于“或”等于“)。 -
11、在一定温度下,对冰醋酸加水稀释的过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。下列说法正确的是( )
 A、a、b、c三点对应的溶液中,由小到大的顺序为c<b<a B、a、b、c三点对应的溶液中,的电离程度最大的是b点 C、向b点对应的溶液中加入碳酸钠固体,可增强溶液的导电性 D、在稀释过程中,随着醋酸浓度的减小,保持增大趋势
A、a、b、c三点对应的溶液中,由小到大的顺序为c<b<a B、a、b、c三点对应的溶液中,的电离程度最大的是b点 C、向b点对应的溶液中加入碳酸钠固体,可增强溶液的导电性 D、在稀释过程中,随着醋酸浓度的减小,保持增大趋势 -
12、用某化学兴趣小组同学通过测量氯化铵溶液的pH在实验前后的变化,探究影响盐类水解的因素,根据实验现象和原理,下列对水解程度判断正确的是( )
选项
实验
pH变化
水解程度
A
加入氯化铵固体
减小
增大
B
加热氯化铵溶液
减小
减小
C
加入醋酸钠固体
增大
增大
D
加入NaCl溶液
增大
不变
A、A B、B C、C D、D -
13、25℃时,水的电离达到平衡:; , 下列叙述正确的是( )A、向水中加入稀氨水,平衡逆向移动,降低 B、将水加热,增大,pH不变 C、向水中加入少量固体CH3COONa,平衡逆向移动,降低 D、向水中加入少量固体硫酸氢钠,增大,不变
-
14、下列有关溶液的酸碱性的说法错误的是( )A、一定温度下,越小,溶液酸性越强 B、的溶液中,一定存在 C、或较小时,用表示溶液酸碱性更方便 D、溶液的酸碱性取决于溶液中和的相对大小
-
15、在给定条件下,下列电离方程式的书写正确的是( )A、亚硫酸氢钠在水溶液中的电离: B、的电离: C、的碱式电离: D、在水溶液中的电离:
-
16、已知: , 不同条件下反应进程的能量变化如图所示。下列说法正确的是( )
 A、该反应达平衡时,升高温度,v(正)增大,v(逆)减小,平衡逆向移动 B、过程b使用了催化剂,使反应的减小 C、由可知,该反应低温能自发进行 D、恒温恒容条件下通入氦气,可使单位体积内的活化分子数增大
A、该反应达平衡时,升高温度,v(正)增大,v(逆)减小,平衡逆向移动 B、过程b使用了催化剂,使反应的减小 C、由可知,该反应低温能自发进行 D、恒温恒容条件下通入氦气,可使单位体积内的活化分子数增大 -
17、为探究外界条件对反应:的影响,以A和B的物质的量之比为m∶n开始反应,通过实验得到不同条件下反应达到平衡时Z的物质的量分数与压强及温度的关系,实验结果如图所示。下列判断不正确的是( )
 A、 B、 C、其它条件相同,升高温度,增大的幅度小于v逆增大的幅度 D、其它条件相同,压强增大,平衡正向移动,平衡常数不变
A、 B、 C、其它条件相同,升高温度,增大的幅度小于v逆增大的幅度 D、其它条件相同,压强增大,平衡正向移动,平衡常数不变 -
18、下列能用勒夏特列原理解释的是( )A、为保存溶液,要在溶液中加入少量铁粉 B、用饱和食盐水除去中的HCl,可以减少氯气的损失 C、对平衡体系增大压强可使颜色变深 D、工业上催化氧化成的反应,选用常压条件而不选用高压
-
19、在密闭容器中进行反应:X(g)+3Y(g)═2Z(g),有关下列图像的说法错误的是( )
 A、依据图a可判断正反应为放热反应 B、在图b中,虚线可表示使用了催化剂 C、若正反应的△H>0,图c可表示升高温度正逆化学反应速率变化图 D、由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的ΔH<0
A、依据图a可判断正反应为放热反应 B、在图b中,虚线可表示使用了催化剂 C、若正反应的△H>0,图c可表示升高温度正逆化学反应速率变化图 D、由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的ΔH<0 -
20、据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇(CH3CH2OH)已成为现实:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g),下列叙述错误的是( )A、使用Cu—Zn—Fe催化剂可大大提高生产效率 B、升高温度,该反应平衡常数K一定增大 C、充入大量CO2气体可提高H2的转化率 D、从平衡混合气体中分离出CH3CH2OH和H2O,可提高CO2和H2的利用率