-
1、亚磷酸()是一种弱酸,其与足量的NaOH反应的化学方程式为 , 亚磷酸受热分解的方程式为。下列说法正确的是( )A、属于酸式盐 B、亚磷酸属于二元酸 C、在水溶液中的电离方程式为 D、亚磷酸受热分解的过程中,被氧化的亚磷酸和被还原的亚磷酸分子个数比为1∶3
-
2、下列鉴别的方法中,所用试剂、操作或方法不正确的是( )A、用溶液鉴别溶液和溶液 B、用酚酞或氯水鉴别NaI溶液和溶液 C、利用焰色试验鉴别溶液和溶液 D、利用丁达尔效应鉴别胶体和溶液
-
3、下列离子方程式书写正确的是( )A、铁与稀盐酸反应: B、粉末加入到硫酸溶液中: C、向澄清石灰水中滴加过量: D、向溶液中加入少量的NaOH溶液:
-
4、某化学小组需要配制480 mL 0.5mol⋅L的NaOH溶液,下列实验操作会使所得溶液浓度偏低的是( )A、用托盘天平称取9.6 g NaOH固体 B、向小烧杯中加水使氢氧化钠溶解并冷却至室温 C、定容过程观察容量瓶内液面时俯视刻度线 D、把溶液转移到洗净但未干燥的容量瓶中
-
5、二氧化氯()是国际上公认的安全、低毒的绿色消毒剂。制取的微观过程如图所示。下列说法正确的是( )
 A、该反应属于置换反应 B、该反应中所有含氯物质均具有杀菌消毒作用 C、制取1 mol 需消耗22.4 L(标准状况) D、该反应的离子方程式为
A、该反应属于置换反应 B、该反应中所有含氯物质均具有杀菌消毒作用 C、制取1 mol 需消耗22.4 L(标准状况) D、该反应的离子方程式为 -
6、为阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,22.4 L空气中含有的单质分子数为 B、12.0 g熔融的中含有的阳离子数为 C、1 mol 溶于水,此过程中转移电子数为 D、常温下,1 L 0.5 mol⋅L 溶液中含有的数为
-
7、下列有关物质性质与用途不具有对应关系的是( )A、受热易分解,可用于治疗胃酸过多 B、能与反应放出氧气,可用于制作呼吸面具 C、Na具有强还原性,可用于制备金属钛 D、氯水具有较强的氧化性,可用于漂白织物
-
8、室温下,下列各组离子在指定溶液(溶质物质的量浓度均为0.1 mol⋅L)中一定能够大量共存的是( )A、NaOH溶液:、、、 B、NaCl溶液: , 、、 C、溶液:、、、 D、NaClO溶液:、、 ,
-
9、导体中自由的带电微粒在电场作用下发生定向移动从而形成电流,如金属铜、熔融的NaCl、NaCl·溶液都是导体。下列说法正确的是( )A、因为金属有较好的导电性,所以它属于电解质 B、电解质都能电离产生离子,因此都属于导体 C、水分子或加热至熔融态都会使氯化钠发生电离 D、液态氯化氢不能导电,故氯化氢不属于电解质
-
10、多角度认识物质的性质是化学研究的基本任务。下列有关酸、碱、盐的认识正确的是( )A、宏观:复分解反应一定有气体、沉淀和水生成 B、微观:盐的水溶液中一定含有金属元素 C、实验:用pH试纸测得某溶液呈强酸性,其溶质不一定是酸 D、变化:反应后只生成盐和水的两种物质一定是酸和碱
-
11、2023年诺贝尔化学奖授予了叶基莫夫等三位科学家以表彰他们为发现和合成量子点作出的贡献。利用颜色来自氯化铜的纳米颗粒,叶基莫夫证明了粒子大小通过量子效应影响玻璃的颜色。下列说法错误的是( )A、叶基莫夫实验用的有色玻璃属于固溶胶 B、叶基莫夫实验用的氯化铜颗粒能透过滤纸 C、叶基莫夫实验用的氯化铜颗粒是纯净物 D、添加氯化铜纳米颗粒的玻璃一定是蓝色的
-
12、氨氮废水中含有氨和铵盐,直接排放会造成环境污染。可用以下方法处理:(1)、沉淀法

①“氧化”时在微生物的催化作用下,被氧化为。该反应的化学方程式为。
②“沉淀”中将“氧化”步骤后剩余的转化为沉淀,发生反应的离子方程式为。
③若调节pH过大,会降低氨氮去除率,其原因为。
(2)、生物硝化反硝化法生物硝化反硝化法可将酸性废水中的氨氮转化为氮气,其原理如图-1所示。

图-1
①硝化过程中溶液的pH。(填“升高”或“降低”)。
②每处理含的酸性废水,理论上消耗的物质的量为。
(3)、电解间接氧化处理法最近我国科学家开发了如图-2所示电解装置,可将氨氮氧化去除。处理前先调节废水 , 通电后可将其转化为无害气体。

图-2
请结合电极反应式简述其去除氨氮的化学原理。
-
13、已知: , 氢氧化铜悬浊液受热易分解生成。蚀刻含铜电路板有多种方法,用蚀刻废液可制备。(1)、酸性蚀刻液法(过氧化氢-盐酸法)。
①用过氧化氢和盐酸蚀刻含铜电路板时发生的离子反应方程式为。
②反应后有气泡产生,且反应一段时间后,随着溶液变蓝,产生气泡的速率加快,可能的原因是。
(2)、碱性蚀刻液法。碱性含铜蚀刻液主要成分为、氨水、氯化铵等。蚀刻过程中,与电路板上的铜发生反应生成 , 失去蚀刻能力,通入空气可恢复蚀刻能力。①中键的数目为。
②蚀刻能力恢复的化学方程式为。
(3)、酸性蚀刻废液与碱性蚀刻废液混和可析出沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图-1所示。不同pH时,铜元素回收率如图-2所示。

图-1 图-2
①为减少胶体形成而影响后续操作,溶液A为(选填“酸性”或“碱性”)蚀刻废液。
②时,铜元素回收率下降的原因为。
(4)、设计从酸性蚀刻废液中制备氧化铜的实验方案。向一定质量的酸性蚀刻废液中。
(实验中必须使用的试剂:20%溶液、硝酸银溶液、稀硝酸、蒸馏水)
-
14、安立生坦(G)是一种用于治疗肺动脉高压的药物,其一种合成路线如下:
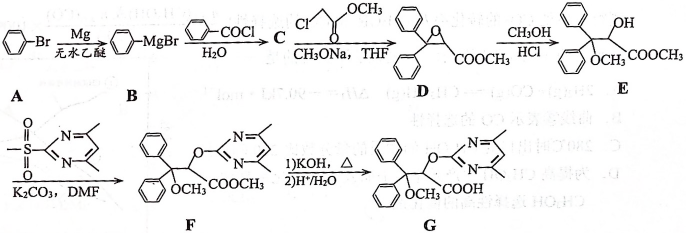 (1)、E分子中发生和杂化的碳原子个数之比为。(2)、已知常温下甲醇和苯酚的电离平衡常数分别为和 , 则甲醇钠的碱性比苯酚钠。(填“强”或“弱”)(3)、C的分子式为 , 其结构简式为。(4)、E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式。
(1)、E分子中发生和杂化的碳原子个数之比为。(2)、已知常温下甲醇和苯酚的电离平衡常数分别为和 , 则甲醇钠的碱性比苯酚钠。(填“强”或“弱”)(3)、C的分子式为 , 其结构简式为。(4)、E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式。①能与发生显色反应。
②在碱性条件下水解,酸化后所得产物均含有苯环,一种产物只有2种不同化学环境的氢原子,另一种产物分子有4种不同化学环境的氢原子,且个数比为9:2:2:1
(5)、E到F的反应类型为。(6)、设计由、和 为原料制备化合物
为原料制备化合物 的合成路线。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 -
15、回收再利用金属冶炼厂的酸性废水(主要含、、、、),制备亚砷酸铜的流程如下。
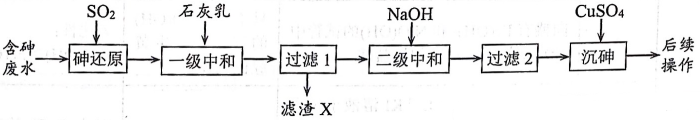 (1)、基态砷原子的电子排布式为。(2)、砷的还原。常温下,五价砷溶液中各种微粒的物质的量分数随pH的变化曲线如图所示。向酸性废水中通入 , 能把五价砷转化为三价砷。
(1)、基态砷原子的电子排布式为。(2)、砷的还原。常温下,五价砷溶液中各种微粒的物质的量分数随pH的变化曲线如图所示。向酸性废水中通入 , 能把五价砷转化为三价砷。
①的二级电离平衡常数。
②pH为1时“还原”的主要反应的离子方程式为。
(3)、中和除杂。当溶液中离子浓度小于 , 可认为已经完全除去。已知:在时开始转化为 , , , 。
①一级中和控制pH为2左右,滤渣X的主要成分有。
②二级中和沉淀重金属离子应控制pH范围为。
(4)、应用碘量法可测定亚砷酸铜中的铜含量。称取2.000g试样溶于稀搅拌后过滤,洗涤滤渣,将洗涤后的滤液与原滤液合并,配成溶液,取所配溶液于碘量瓶中加入过量的碘化钾溶液,用标准溶液滴定至终点,消耗。①计算样品中铜元素的质量分数。(写出计算过程)
②已知纯亚砷酸铜中铜元素的质量分数为23.02%,实际测得样品中铜元素的质量分数有偏差(操作步骤均正确)的原因为。
(已知:; , 未配平)
-
16、催化加氢制的反应体系中,发生的主要反应如下:
反应1:
反应2:
恒压下,将起始的混合气体以一定流速通过装有催化剂的反应管,测得出口处的转化率及和的选择性[]随温度的变化如下图所示。下列说法不正确的是( )
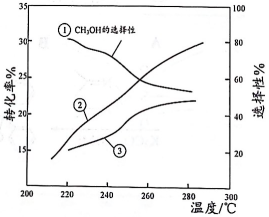 A、 B、曲线③表示CO的选择性 C、280℃时出口处的物质的量分数比220℃时小 D、为提高生产效率,需研发转化率高和选择性高的催化剂
A、 B、曲线③表示CO的选择性 C、280℃时出口处的物质的量分数比220℃时小 D、为提高生产效率,需研发转化率高和选择性高的催化剂 -
17、室温下,用溶液制备的过程如下图所示。
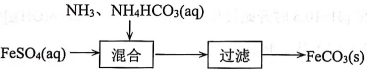
已知: , ,
下列说法正确的是( )
A、溶液: B、溶液中: C、混合过程中,会发生的反应为: D、过滤后的滤液中: -
18、下列实验操作和现象,得出的相应结论均正确的是( )
选项
实验操作
现象
结论
A
向盛有和的试管中分别滴加相同浓度的浓盐酸
只有盛的试管中产生黄绿色气体
氧化性:
B
取溶液于试管中,加入溶液,充分反应后滴入5滴15%溶液
溶液变为血红色
与的反应有一定限度
C
乙醇和浓硫酸共热至170℃,将产生的气体通入溴水中
溴水褪色
乙烯发生了加成反应
D
向溶液中滴加溶液
出现黄色沉淀
发生了水解反应
A、A B、B C、C D、D -
19、某MOFs多孔材料孔径大小和形状恰好将“固定”,能高选择性吸附。废气中的被吸附后,经处理能全部转化为。原理示意图如下。
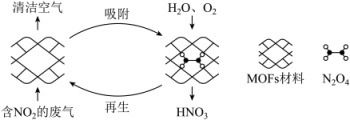
下列说法不正确的是( )
A、该反应 B、多孔材料“固定” , 促进平衡正向移动 C、已知的平衡常数为K , 温度升高,K值减少 D、每获得时,转移电子的数目约为 -
20、化合物Z是合成抗肿瘤药物异甘草素的重要中间体,其合成路线如下:
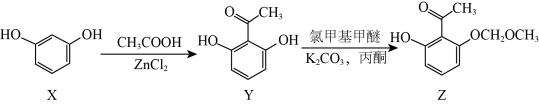
下列有关化合物X、Y和Z的说法正确的是( )
A、X分子中的所有原子一定共平面 B、Y能发生加成、氧化和消去反应 C、Z与足量的氢气加成后的产物分子中含有3个手性碳原子 D、Y转化为Z的过程中,要控制氯甲基甲醚的用量