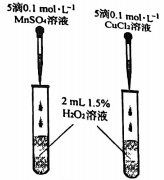
-
1、物质与同时发生,反应Ⅰ: , 反应Ⅱ: 。反应历程如图,下列说法不正确的是( )
 A、 B、相同条件下,反应Ⅰ更快达到平衡 C、降低温度,平衡时的物质的量分数增大 D、升高温度,反应Ⅰ、Ⅱ的反应速率都增大
A、 B、相同条件下,反应Ⅰ更快达到平衡 C、降低温度,平衡时的物质的量分数增大 D、升高温度,反应Ⅰ、Ⅱ的反应速率都增大 -
2、前4周期主族元素、、、的原子序数依次增大,是空气中含量最多的元素,的周期序数与族序数相等,基态时原子原子轨道上有5个电子,与位于同一主族。下列说法正确的是( )A、元素的电负性: B、原子半径: C、的第一电离能比同周期相邻元素的大 D、的简单气态氢化物的热稳定性比的弱
-
3、下列事实不能用勒夏特列原理解释的是( )A、唾液可以使淀粉水解速率加快 B、坚持使用含氟牙膏可预防龋齿 C、打开碳酸饮料瓶盖时产生气泡 D、中毒的病人进入高压氧舱中接受治疗
-
4、对于可逆反应 , 其他条件不变时,产物的质量分数与温度或压强的关系如图所示,下列说法正确的是( )
 A、 , B、升温,的转化率提高 C、该式中化学计量数 D、加压时,平衡向逆反应方向移动
A、 , B、升温,的转化率提高 C、该式中化学计量数 D、加压时,平衡向逆反应方向移动 -
5、设为阿伏加德罗常数的值。下列说法正确的是( )A、和充分反应后分子总数为 B、的溶液中的数目为 C、电解熔融 , 阳极有的生成,转移电子数为 D、常温下,的溶液中,由水电离出的数目为
-
6、化学有独特的符号表达形式。下列说法正确的是( )A、用铁电极电解氯化镁溶液: B、钢铁发生吸氧腐蚀时,铁电极的电极反应式: C、用除去废水中的重金属: D、加热氯化铜溶液颜色由蓝变黄绿色:
-
7、探究醋酸浓度与电离度()关系的步骤如下,与相关步骤对应的操作或叙述正确的( )
步骤
操作或叙述
A
Ⅰ.用标准溶液标定醋酸溶液浓度
滴定时应始终注视滴定管中的液面
B
Ⅱ.用标定后的溶液配制不同浓度的醋酸溶液
一定要使用干燥的容量瓶
C
Ⅲ.测定步骤Ⅱ中所得溶液的
应在相同温度下测定
D
Ⅳ.计算不同浓度溶液中醋酸的电离度
计算式为
A、A B、B C、C D、D -
8、下列推论正确的是( )A、 ;则石墨比金刚石稳定 B、 ;则碳的燃烧热为 C、 , ;则 D、 、;则该反应在高温时才能自发进行
-
9、二氧化硫空气质子交换膜燃料电池可以利用大气所含的快速启动,装置示意图如下。以下说法正确的是( )
 A、正极发生氧化反应 B、电子由沿导线流向 C、负极电极反应式为 D、反应 , 有质子通过交换膜
A、正极发生氧化反应 B、电子由沿导线流向 C、负极电极反应式为 D、反应 , 有质子通过交换膜 -
10、将一定量纯净的氨基甲酸铵置于恒容密闭真空容器中(固体试样体积忽略不计),在恒温下使其达到分解平衡:。能判断该反应已经达到化学平衡状态的是( )A、气体的总物质的量不再变化 B、浓度不再发生改变 C、混合气体的平均相对分子质量不变 D、二氧化碳气体的体积分数不再发生改变
-
11、在恒温恒容条件下,发生反应 , 随时间的变化如图中曲线甲所示。下列说法不正确的是( )
 A、压缩体积加压平衡不移动 B、在不同时刻都存在关系: C、其他条件不变,向体系中加入催化剂得到曲线乙 D、由、两点坐标可求得从到时间间隔内该化学反应的平均速率
A、压缩体积加压平衡不移动 B、在不同时刻都存在关系: C、其他条件不变,向体系中加入催化剂得到曲线乙 D、由、两点坐标可求得从到时间间隔内该化学反应的平均速率 -
12、化学是一门以实验为基础的学科。下列实验说法不正确的是( )
 A、图①装置可用于强酸与强碱的稀溶液中和热测定 B、图②装置可用于排出盛装溶液滴定管尖嘴内的气泡 C、图③装置可用于溶液直接蒸干制取无水固体 D、图④装置盐桥中阴离子向溶液中迁移
A、图①装置可用于强酸与强碱的稀溶液中和热测定 B、图②装置可用于排出盛装溶液滴定管尖嘴内的气泡 C、图③装置可用于溶液直接蒸干制取无水固体 D、图④装置盐桥中阴离子向溶液中迁移 -
13、已知过氧化氢分解生成氢气和氧气是放热反应。科研人员采用新型复合光催化剂,利用太阳光高效分解水的过程如下图所示,下列说法正确的是( )
 A、该过程中催化剂可以降低反应的焓变 B、过程Ⅰ放出热量,过程Ⅱ吸收热量 C、该过程均涉及到极性键和非极性键的断裂和形成 D、过程Ⅲ中断裂旧键吸收的能量小于形成新键放出的能量
A、该过程中催化剂可以降低反应的焓变 B、过程Ⅰ放出热量,过程Ⅱ吸收热量 C、该过程均涉及到极性键和非极性键的断裂和形成 D、过程Ⅲ中断裂旧键吸收的能量小于形成新键放出的能量 -
14、“幸福不会从天降,美好生活靠劳动创造”。下列劳动项目与所述化学知识没有关联的是( )
选项
劳动项目
化学原理
A
家务劳动:用食醋洗去水壶中的水垢
醋酸的酸性比碳酸强
B
学农活动:种豆科植物可少施氮肥
根瘤菌可自然固氮
C
学工活动:给铁制钥匙镀上铜层
在阴极放电生成铜单质
D
实践活动:用泡沫灭火剂进行消防演习
溶液中和发生双水解
A、A B、B C、C D、D -
15、生产、生活离不开化学。下列说法正确的是( )A、加适量可减缓葡萄酒的变质速率 B、将硝铵化肥()与草木灰()混用,效果更好 C、电热水器用镁棒防止内胆腐蚀,采用的是外加电流法 D、汽车上安装尾气催化转化器,可提高转化为的平衡转化率
-
16、原子结构奥秘的探索史漫长而曲折。下列有关表述正确的是( )
图1
 图2
图2 图3
图3 A、图1可表示原子的电子云轮廓图 B、图2可表示基态原子价层电子轨道表示式 C、图3是灼烧食盐的焰色呈黄色,与原子核外电子跃迁释放能量有关 D、基态原子的核外电子排布式可表示为:
A、图1可表示原子的电子云轮廓图 B、图2可表示基态原子价层电子轨道表示式 C、图3是灼烧食盐的焰色呈黄色,与原子核外电子跃迁释放能量有关 D、基态原子的核外电子排布式可表示为: -
17、中华民族的发明创造为人类文明进步做出了巨大贡献。下列过程主要是利用化学反应中能量变化的是( )
A
B
C
D

九章三号量子计算机

神舟十七载人飞船发射
打磨磁石制司南

粮食酿醋
A、A B、B C、C D、D -
18、利用可以制备合成气(和CO)。(1)、与重整。
①已知:燃烧热;燃烧热;燃烧热。
则反应Ⅰ:。
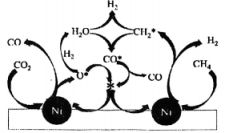
②在基催化剂作用下,该反应的可能机理如图所示。已知转化的表达式为 , 写出转化为的表达式:。
③与重整反应制备合成气中的主要副反应为:
Ⅱ.
Ⅲ.
Ⅳ.
在、进气流速相同、时,做催化剂,反应相同时间测得与的转化率随温度变化如图所示(仅考虑上述反应)。
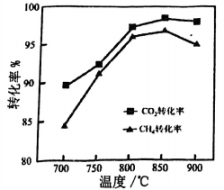
不同温度下转化率始终大于转化率的主要原因为。 , 随温度升高与转化率均下降的可能原因为。
(2)、部分氧化重整。反应原理为;。与该方法相比,和重整的优点是。
(3)、与、、三重整。在密闭容器中,、时,与的平衡转化率、与的平衡产率随温度变化如图所示。

在时,平衡转化率为负值的可能原因为(用化学方程式表示)、。
-
19、实验室制备的装置如图所示。
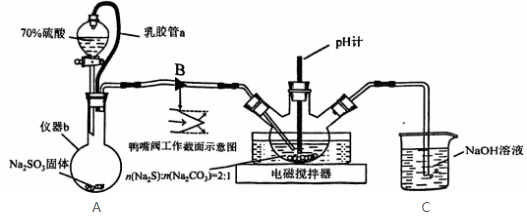 (1)、装置A中乳胶管a的作用为;仪器b的名称为。(2)、装置B为鸭嘴阀,尖嘴处为弹性可开合橡胶,结构如图所示,其作用为。(3)、装置C中的反应分三步:第一步、第二步(用化学方程式表示)、第三步。(4)、装置C中约为7时停止通入气体,过高或过低均使的产量下降,其原因为。(5)、用饱和溶液制备(水溶液中、、的物质的量分数随的分布如图1所示,的溶解度曲线如图2所示)。
(1)、装置A中乳胶管a的作用为;仪器b的名称为。(2)、装置B为鸭嘴阀,尖嘴处为弹性可开合橡胶,结构如图所示,其作用为。(3)、装置C中的反应分三步:第一步、第二步(用化学方程式表示)、第三步。(4)、装置C中约为7时停止通入气体,过高或过低均使的产量下降,其原因为。(5)、用饱和溶液制备(水溶液中、、的物质的量分数随的分布如图1所示,的溶解度曲线如图2所示)。图1
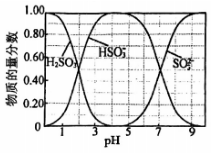 图2
图2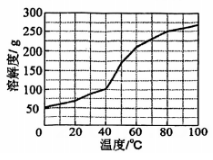
请补充完整实验方案:边搅拌边向饱和溶液中加入 , 停止滴加后在加热条件下,边搅拌边向其中加入硫粉至不再溶解,过滤, , 用无水乙醇洗涤晶体2~3次,低温干燥。(须使用试剂:NaOH溶液)
-
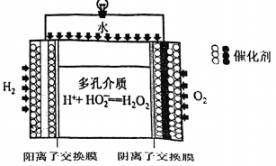
20、过氧化氢()是一种环境友好的氧化剂。(1)、的电化学合成。两电极反应产生的离子在多孔介质中生成的原理如图所示,正极的电极反应式为。
 (2)、含量的测定。取溶液样品配制成250mL溶液,取mL待测液于碘量瓶中,加入适量溶液和过量KI溶液,发生反应 , 密封在暗处静置;用溶液滴定至溶液呈微黄色,加入适量淀粉溶液,继续滴定至终点。滴定时发生反应。重复实验两次,平均消耗溶液的体积为。
(2)、含量的测定。取溶液样品配制成250mL溶液,取mL待测液于碘量瓶中,加入适量溶液和过量KI溶液,发生反应 , 密封在暗处静置;用溶液滴定至溶液呈微黄色,加入适量淀粉溶液,继续滴定至终点。滴定时发生反应。重复实验两次,平均消耗溶液的体积为。①判断达到滴定终点的标志为。
②通过上述数据,计算样品中的质量分数。(写出计算过程)
(3)、分解的探究。①已知分解放出的热,在含少量的溶液中,的分解机理为:
Ⅰ.(慢),Ⅱ.(快)。
下列说法正确的是____(填字母)。
A、反应的速率与的浓度有关 B、是该反应的催化剂 C、反应Ⅰ的活化能小于反应Ⅱ的活化能 D、的总能量比的高(4)、为比较和对分解的催化效果,研究小组设计了如图所示的实验。该实验能否达到实验目的,若不能,请提出改进意见。