-
1、反应在恒温恒容下达到平衡,下列说法可以作为该反应已达到平衡的判据是( )A、气体的总物质的量不变 B、气体的总质量不变 C、与的浓度相同 D、容器内气体的密度不变
-
2、离子鉴别能让我们感受微观世界的神奇.下列各组离子在给定溶液中能大量共存的是( )A、滴加几滴溶液显血红色的溶液中: B、无色透明溶液中: C、的溶液中: D、能使酚酞变红的溶液中:
-
3、2024年的奥运会将在巴黎举行,沙滩排球比赛场地将设在埃菲尔铁塔前的战神广场,埃菲尔铁塔为钢铁结构,使用了250万个铆钉和近两万块铁片,下列说法正确的是( )A、连接铁片的铆钉应该用铜质的 B、巴黎的气候比较潮湿,不易引起钢铁的生锈 C、为了减缓钢铁生锈,可以在铁塔表面镀一层锡 D、在铁塔表面涂上一层特制的油漆,能有效保护金属
-
4、为阿伏加德罗常数的值.下列说法正确的是( )A、过氧化钠中阴离子数为 B、溶液中含有的数为 C、 , 含有个中子 D、(标准状况)苯在中完全燃烧,得到个分子
-
5、宏观辨识与微观探析是化学学科核心素养之一,下列反应的离子方程式书写错误的是( )A、漂白粉溶液吸收后产生白色沉淀: B、氯气通入氢氧化钠溶液制“84”消毒液: C、过氧化钠溶于水制氧气: D、用氯化铁溶液蚀刻覆铜板:
-
6、相同温度下,等物质的量浓度的下列溶液中,值最小的是( )A、 B、 C、 D、
-
7、下列有关化学用语正确的是( )A、的电离方程式: B、氯分子的电子式: C、次氯酸的结构式: D、氟原子的结构示意图:

-
8、建设美丽乡村,守护中华家园,衣食住行皆化学.下列说法错误的是( )A、爆竹烟花迎佳节,烟花呈现的是锂钠钾锶钡等金属元素的焰色 B、乡村公路铺沥青,沥青属于石油加工产品 C、千家万户通光纤,光纤的主要材质为 D、均衡膳食助健康,主食中的淀粉可水解为葡萄糖
-
9、立德粉(主要成分为)常用作颜料.以粗氧化锌(主要成分为 , 还含少量等杂质)和为原料制备立德粉的流程如图所示:
 (1)、写出“酸浸”过程中发生反应的化学方程式: .(2)、加入的作用是 , 发生反应的离子方程式为 .(3)、分离出的实验操作名称为 .(4)、“除杂Ⅱ”中加入过量的锌粉主要除去(填离子符号),该反应的反应类型为 .(5)、“滤渣”的成分是 .(6)、“共沉淀”时,若与恰好转化为 . 所得溶液中除少量外,还含有的阳离子有(填离子符号).
(1)、写出“酸浸”过程中发生反应的化学方程式: .(2)、加入的作用是 , 发生反应的离子方程式为 .(3)、分离出的实验操作名称为 .(4)、“除杂Ⅱ”中加入过量的锌粉主要除去(填离子符号),该反应的反应类型为 .(5)、“滤渣”的成分是 .(6)、“共沉淀”时,若与恰好转化为 . 所得溶液中除少量外,还含有的阳离子有(填离子符号). -
10、氯气广泛应用于杀菌、消毒及化工领域.某实验小组利用软锰矿和浓盐酸以及图所示装置(部分装置省略)制备干燥、纯净的氯气并探究其性质.
请回答下列问题:
 (1)、①中仪器A的名称为 , 该实验中仪器的连接顺序应为 , 实验过程中产生氯气的离子方程式为 .(2)、装置中使用饱和食盐水的目的为 .(3)、溶液的作用是 , 实验过程中溶液中反应的化学方程式为 , 下列可代替溶液的试剂有(填序号).
(1)、①中仪器A的名称为 , 该实验中仪器的连接顺序应为 , 实验过程中产生氯气的离子方程式为 .(2)、装置中使用饱和食盐水的目的为 .(3)、溶液的作用是 , 实验过程中溶液中反应的化学方程式为 , 下列可代替溶液的试剂有(填序号).A. B. C.澄清石灰水 D.
(4)、用制得的氯气做如图甲所示的实验,向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡,先利用注射器滴加溶液,再利用注射器滴加盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图乙所示.阶段①说明氯气溶于水,溶于水的氯气部分与水反应,阶段②的压强变小,是因为和溶液发生了氧化还原反应,阶段③发生反应的离子方程式为 .
-
11、如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分,试根据标签上的相关数据回答下列问题:
硫酸化学纯
品名:硫酸
化学式:
相对分子质量:98
密度:
质量分数:98%
实验室欲用上述浓硫酸和蒸馏水配制的稀硫酸:
(1)、完成本实验所必需的仪器有:烧杯、玻璃棒、、、量筒等.(2)、配制溶液前必须进行的操作是 .(3)、计算该浓硫酸中的物质的量浓度为 .(4)、用量筒量取该浓硫酸时应选用的量筒规格为____(填序号).A、 B、 C、 D、(5)、稀释时的操作为 .(6)、下列操作会使所配溶液浓度偏低的是____(填序号).A、定容时仰视读数 B、量取浓硫酸的量筒未洗涤 C、容量瓶用蒸馏水洗净后仍残留有蒸馏水 D、定容摇匀后,发现液面低于刻度线,再加水至刻度线 -
12、下表是元素周期表的一部分,请回答有关问题:
族
周期
0
一
二
①
②
三
③
④
⑤
⑥
⑦
(1)、在元素中,金属性最强的元素是(填元素符号).(2)、元素①是空气中含量最多的元素,其单质的电子式为 .(3)、在②、③、④这些元素形成的最简单离子中,离子半径由大到小的顺序为(填离子符号).(4)、由元素②和③可形成两种离子化合物,其中具有强氧化性的物质的化学式为 .(5)、在这些元素的最高价氧化物对应的水化物中,酸性最强的物质是(填名称).(6)、⑥和⑦两种元素的最低价气态氢化物的热稳定性大小为(填化学式)(7)、写出元素⑤的氧化物与元素③最高价氧化物对应的水化物发生反应的离子方程式: .(8)、元素②和⑦组成的一种氧化物是黄绿色气体,被称为“第四代”饮用水消毒剂.其中元素⑦的原子显价,该氧化物的制备方法为:在平底烧瓶中加入固体、足量草酸、稀硫酸,水浴加热.则反应的化学方程式为 . -
13、是优良的水处理剂,一种制备方法是将混合共熔,反应方程式为 . 下列说法错误的是( )A、中铁元素的化合价为价 B、具有氧化杀菌作用 C、发生氧化反应 D、当生成时,转移电子数为
-
14、将和空气的混合气体通入和的混合溶液中回收S,其转化如图所示(不溶于水),下列说法正确的是( )
 A、过程①发生的是氧化还原反应 B、过程②发生反应的离子方程式为 C、通过图示可知氧化性: D、整个转化过程中不参与循环利用
A、过程①发生的是氧化还原反应 B、过程②发生反应的离子方程式为 C、通过图示可知氧化性: D、整个转化过程中不参与循环利用 -
15、下列实验操作和现象及结论都正确的是( )
选项
实验操作和现象
结论
A
和的水溶液中滴加溶液
均有白色沉淀产生
B
取少量溶液X加入稀盐酸至溶液呈酸性,产生使澄清石灰水变浑浊的无色无味气体
该溶液中含有
C
取少量金属放在坩埚中灼烧,产生白色固体
该白色固体为
D
用洁净的玻璃棒蘸取待测液在酒精灯上灼烧,火焰呈黄色
该溶液中不含
A、A B、B C、C D、D -
16、向溶液中滴入几滴酚酞溶液,然后逐滴加入稀硫酸,测得混合溶液的导电能力随时间变化如图所示.下列说法正确的是( )
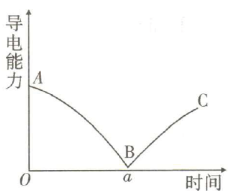 A、段发生反应的离子方程式为 B、B点溶液不导电是因为是非电解质 C、段溶液的导电能力不断增大,主要是由于过量的稀硫酸在水中电离产生自由移动的和 D、混合溶液的颜色在a时刻仍为红色
A、段发生反应的离子方程式为 B、B点溶液不导电是因为是非电解质 C、段溶液的导电能力不断增大,主要是由于过量的稀硫酸在水中电离产生自由移动的和 D、混合溶液的颜色在a时刻仍为红色 -
17、下列反应的离子方程式书写正确的是( )A、过氧化钠与水的反应: B、钠与水反应: C、腐蚀印刷电路板: D、用稀硫酸处理铁锈:
-
18、部分含铁物质的分类与相应化合价关系如图所示.下列推断合理的是( )
 A、的每步转化均可一步实现 B、通过化合反应不能直接得到d C、物质c溶于氢碘酸的离子方程式为 D、只用溶液即可检验f中的阳离子
A、的每步转化均可一步实现 B、通过化合反应不能直接得到d C、物质c溶于氢碘酸的离子方程式为 D、只用溶液即可检验f中的阳离子 -
19、用下列装置或操作进行相应实验,能达到实验目的的是( )
选项
A
B
C
D
目的
除去中的
探究氧化性:
稀释浓硫酸
称取一定质量的固体
装置或操作



 A、A B、B C、C D、D
A、A B、B C、C D、D -
20、设为阿伏加德罗常数的值,下列说法正确的是( )A、的质量是 B、中含有的原子总数约为 C、的物质的量为 D、溶液中含溶质的质量为