-
1、短周期主族元素W、X、Y、Z、Q原子序数依次增大,形成的化合物是一种重要的食品添加剂,结构如图所示。Z核外最外层电子数与X核外电子总数相等。W的原子半径在周期表中最小。下列有关叙述正确的是( )。
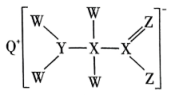 A、原子半径大小:Y>Z>Q B、W、Y、Z三种元素可形成离子化合物 C、该化合物中Y原子不满足8电子稳定结构 D、Z与W可形成 , 其空间结构是直线形
A、原子半径大小:Y>Z>Q B、W、Y、Z三种元素可形成离子化合物 C、该化合物中Y原子不满足8电子稳定结构 D、Z与W可形成 , 其空间结构是直线形 -
2、铝元素是地壳中含量最多的金属元素(约占地壳总量的7.73%),主要以铝土矿形式存在(主要成分是)。要从铝土矿中提取铝,首先要获得纯度较高的氧化铝(熔点:2054℃),主要的工艺流程如图所示:
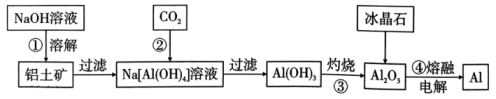
下列说法正确的是( )。
A、碱溶①后,溶液中主要含有的阳离子为和 B、步骤②通入足量反应的离子方程式为 C、灼烧③一般在蒸发皿中进行 D、电解④添加冰晶石的主要作用是降低的熔融温度 -
3、如图所示实验装置及实验结果合理的是( )。
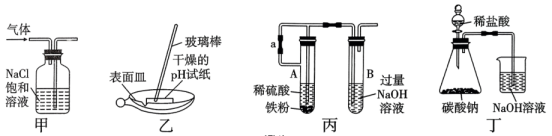 A、实验室用图甲所示装置除去中的少量 B、实验室用图乙所示装置测定氯水的pH C、实验室用图丙所示装置制备少量 , 先打开止水夹a,一段时间后再关闭a D、实验室用图丁所示装置证明非金属性强弱:Cl>C
A、实验室用图甲所示装置除去中的少量 B、实验室用图乙所示装置测定氯水的pH C、实验室用图丙所示装置制备少量 , 先打开止水夹a,一段时间后再关闭a D、实验室用图丁所示装置证明非金属性强弱:Cl>C -
4、下列离子方程式书写正确的是( )。A、向溶液中加入少量溶液: B、二氧化硫使酸性高锰酸钾溶液褪色: C、氢氧化镁与足量稀盐酸反应: D、已知酸性: , 向溶液中通入少量:
-
5、实验室需用硫酸铜溶液,下列有关该溶液的配制说法正确的是( )。A、用托盘天平称取胆矾 B、实验中必须用到的玻璃仪器为:烧杯、量筒、容量瓶、玻璃棒 C、定容时仰视容量瓶的刻度线,会造成所配溶液物质的量浓度偏高 D、定容摇匀后发现液面低于刻度线,应再滴加蒸馏水至刻度线
-
6、侯德榜(图乙)是我国近代著名的化学家,他提出的联合制碱法得到世界各国的认可。以粗盐(含、、等杂质)为主要原料,生产纯碱和化肥 , 实验室模拟工艺流程如图甲所示。下列说法不正确的是( )。
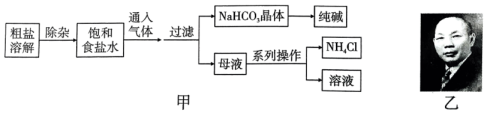 A、对粗盐提纯可依次加入过量、、溶液,过滤后再加入盐酸调pH B、向饱和食盐水中先通 , 再通 , 更有利于析出 C、图甲中析出晶体的总反应可表达为: D、向纯碱溶液中通入过量可以将纯碱溶液转化为溶液
A、对粗盐提纯可依次加入过量、、溶液,过滤后再加入盐酸调pH B、向饱和食盐水中先通 , 再通 , 更有利于析出 C、图甲中析出晶体的总反应可表达为: D、向纯碱溶液中通入过量可以将纯碱溶液转化为溶液 -
7、设为阿伏加德罗常数的值,下列说法正确的是( )。A、标准状况下,含的浓盐酸与足量的反应生成的体积为 B、的溶液中所含阳离子数目为 C、标准状况下,固体中含有的离子总数是 D、单质Fe与足量水蒸气在高温下完全反应,失去个电子
-
8、向两份相同体积、相同物质的量浓度的溶液中,分别滴入物质的量浓度相等的、溶液,其导电能力随滴入溶液体积(V)变化的曲线如图所示。下列说法正确的是( )。
 A、a、d两点对应的溶液均显中性 B、b点时对应的离子方程式为 C、c点时两溶液中的物质的量浓度相同 D、曲线①代表滴加溶液的变化曲线
A、a、d两点对应的溶液均显中性 B、b点时对应的离子方程式为 C、c点时两溶液中的物质的量浓度相同 D、曲线①代表滴加溶液的变化曲线 -
9、下列各组离子在指定溶液中一定能大量共存的是( )。A、常温下,的透明溶液中:、、、 B、与铝反应放出氢气的溶液中:、、、 C、使酚酞变红的溶液中:、、、 D、新制氯水中:、、、
-
10、下列有关周期表、周期律的叙述,正确的是( )。A、第ⅠA族除H外均为碱金属元素,对应单质均需要保存于煤油中 B、第ⅦA族卤素单质与水反应均可以用:来表示 C、同周期简单离子半径随原子序数增大而递减 D、锑(Sb)元素位于第五周期第ⅤA族,原子序数为51
-
11、下列各组物质的转化中,不是通过一步反应实现的是( )。A、 B、 C、 D、
-
12、下列叙述正确的有( )。
①酸性氧化物一定是非金属氧化物
②、都能溶于水生成碱,它们都属于碱性氧化物
③和互为同素异形体
④、、、均可通过化合反应制得
⑤已知: , 则不是电解质
⑥冰中水分子间以氢键结合成排列规整的晶体,体积膨胀密度减小,所以冰浮在水面上
A、1项 B、2项 C、3项 D、4项 -
13、下列关于化学键的说法正确的是( )。A、有化学键断裂的变化一定是化学变化 B、中含有极性键和非极性键 C、受热分解既破坏了离子键,又破坏了极性共价键 D、共价化合物中不可能含有金属元素
-
14、下列化学用语不正确的是( )。A、中子数为18的氯离子: B、的结构式: C、Rb的原子结构示意图:
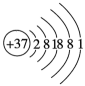 D、的电子式:
D、的电子式:
-
15、下列实验操作描述正确的是( )。A、制备氢氧化铁胶体实验时,用玻璃棒搅拌可加快反应速率 B、进行焰色试验时如无铂丝,可以用洁净的铁丝代替 C、实验剩余的药品都不可以放回原瓶 D、坩埚不可以用明火直接加热
-
16、化学与生活、社会发展息息相关,下列说法正确的是( )。A、“食物腐败,胶体净水,金属的冶炼”都涉及氧化还原反应 B、铁粉常作脱氧剂,生石灰、浓硫酸常作干燥剂 C、苏打可用于治疗胃酸过多 D、从石墨中剥离出的石墨烯薄片能导电,是一种电解质
-
17、无水四氯化锡()常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备并测定产品中含量。
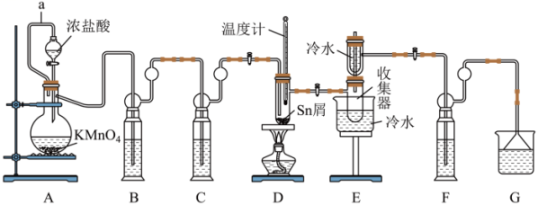
已知:①熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成),且熔融Sn与反应生成时放出大量的热。
②Sn熔点为232℃,无水熔点为246℃、沸点为652℃。
回答下列问题:
(1)、a管的作用是。(2)、装置B、C中的试剂分别为、(填名称)。(3)、为了获得较纯的产品,当D处具支试管中时,再点燃D处酒精灯。反应制得的产品中可能会含有杂质 , 为加快反应速率并防止产品中混有 , 除了通入过量外,还应控制反应的最佳温度范围为。(4)、甲同学欲证明装置A产生的气体中含有HCl,设计如图装置进行实验。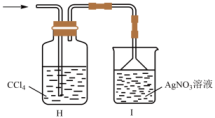
乙同学认为,不能确定进入装置I的气体只有一种,为证明最终进入装置I的气体只有一种,乙同学提出再加一个装置,即可完成论证。请给出改进方案:。
(5)、碘氧化法滴定分析产品中Sn2+的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b mol·L-1碘标准溶液滴定,发生反应:Sn2++I2=Sn4++2I-。滴定终点消耗碘标准溶液V mL,则产品中Sn2+的质量分数为(用含a、b、V的代数式表示)。 -
18、钴在现代有着广泛应用,如草酸钴可作指示剂与催化剂,氯化钴是一种饲料营养强化剂.利用水钴矿(主要成分为 , 含少量、、、MgO、CaO、等)可以制取草酸钴晶体和氯化钴晶体,依据以下制备流程回答下列问题:

已知:①具有强氧化性,②沉淀Ⅰ中只含有两种沉淀,③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
开始沉淀
27
7.6
7.6
4.0
7.7
沉淀完全
3.7
9.6
9.2
5.1
9.8
(1)、为加快钴矿“浸出”效率,可采取的措施是(任写一条),浸出过程中加入的与反应的离子方程式为。(2)、加入的作用是 , 后续加入调pH得到沉淀Ⅰ的成分是。(3)、NaF溶液可将钙、镁离子转化为沉淀过滤除去,若所得滤液中 , 则:。[已知: , ](4)、加入萃取剂可以除去的杂质离子是。(5)、操作Ⅰ包括:向水层加入浓盐酸调整pH为2~3,、过滤、洗涤、减压烘干等过程。(6)、在空气中加热5.49g草酸钴晶体(),受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:[已知:]温度范围/℃
150~210
290~320
890~920
固体质量/g
4.41
2.41
2.25
经测定,210~290℃过程中产生的气体只有 , 此过程发生反应的化学方程式是。
-
19、丙烯是一种重要的化工原料,在催化剂作用下,可以由丙烷直接脱氢或氧化脱氢制备。
反应Ⅰ(直接脱氢):
反应Ⅱ(氧化脱氢):
反应Ⅲ(氢气燃烧):
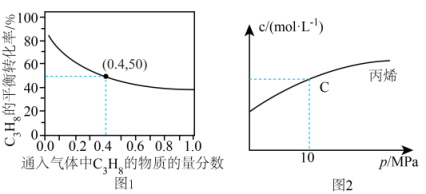
回答下列问题:
(1)、kJ/mol。(2)、对于反应Ⅰ,总压恒定为100kPa,在密闭容器中通入和Ar的混合气体。在温度为时,的平衡转化率与通入气体中的物质的量分数的关系如图1①结合图1,从平衡移动的角度分析,通入Ar的作用是。
②若要将的平衡转化率提高到60%,则。
(3)、恒温条件下,测得反应Ⅰ平衡时的物质的量浓度与平衡总压的关系如图2。请在图上画出平衡时的物质的量浓度随平衡总压变化的曲线。(在图中C点平衡总压为10Mpa时,丙烷和丙烯的物质的浓度相等)(4)、①关于反应Ⅲ,下列说法正确的是。A.该反应在任何温度下都能自发进行
B.升高温度,反应Ⅱ的平衡常数增大
C.通入的氧气越多,越有利于丙烷的氧化脱氢
D.将水液化分离出来,既可以加快反应速率,又能提高的转化率
②与直接脱氢反应相比,氧化脱氢制备丙烯的优点是。
(5)、研究表明,可催化氧化脱氢制丙烯。在p=0.1MPa, , 催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下:t℃
丙烷转化率
产物的选择性
CO
400
4.06
93.12
2.20
4.68
500
12.32
91.23
3.16
5.61
600
35.22
85.44
7.73
6.83
下列说法不正确的是____。
A、在较高温度下,催化剂X可提高产生丙烯反应的速率 B、催化氧化脱氢制丙烯的反应是放热反应 C、相同条件下,使用不同的催化剂,丙烷的平衡转化率相同 D、温度升高,催化剂X的活性下降,丙烯的产率降低 -
20、结晶水合物X由4种元素组成,某学习小组按如下流程进行实验:
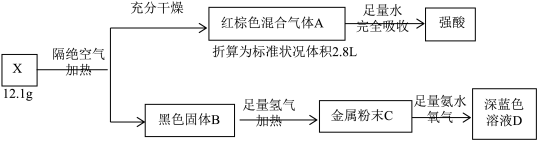
已知:黑色固体B用100mL2.0 mol/L H2SO4溶液溶解后,多余的酸用0.30 mol NaOH恰好中和。
(1)、组成X的元素有H、O和(填元素符号),A的两种成分为(填写化学式)。(2)、写出X隔绝空气加热分解的化学方程式。(3)、写出金属粉末C生成深蓝色D溶液的离子方程式。(4)、黑色固体B加入稀硫酸溶解后,再加入足量氢氧化钠溶液,生成的蓝色沉淀可能是氢氧化物、碱式硫酸盐或两者的混合物(都难溶于水,易溶于强酸),请设计一个实验方案证明蓝色沉淀只有氢氧化物没有碱式硫酸盐:。