-
1、磷酸铁锂电池是以磷酸铁锂(LiFePO4)为正极材料的锂离子电池,具有循环寿命长、安全性能好、无环境污染等特点。(1)、磷酸铁锂具有橄榄石结构,空间骨架结构不易发生形变,化学性质稳定。
①基态的价层电子排布式为。
②Li、P、O三种元素的电负性由大到小的顺序是。
(2)、硫酸亚铁(FeSO4)可用于制备磷酸铁锂。①根据价层电子对互斥理论可知,的空间结构为。
②比较S原子和O原子的第一电离能大小,并从原子结构的角度说明理由:。
(3)、草酸亚铁(FeC2O4)也可用于制备磷酸铁锂。草酸根离子的结构简式为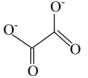 , 其中碳原子的杂化轨道类型为。 (4)、磷酸铁(FePO4)与磷酸铁锂结构相似,其中围绕和分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。充放电过程中,中的会不断脱嵌或嵌入链之间的孔道内,其结构变化如图所示。
, 其中碳原子的杂化轨道类型为。 (4)、磷酸铁(FePO4)与磷酸铁锂结构相似,其中围绕和分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。充放电过程中,中的会不断脱嵌或嵌入链之间的孔道内,其结构变化如图所示。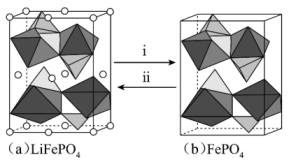
①i表示(填“充电”或“放电”)过程。
②已知Li+的脱嵌率=。某时刻,若正极材料中Li+的脱嵌率为 , 则其中。
-
2、下列实验方案设计、现象和结论不正确的是( )
实验目的
方案设计
现象和结论
A
探究反应物浓度对化学反应速率的影响
分别取10mL0.1mol/LNa2S2O3溶液和5mL0.1mol/LNa2S2O3溶液、5mL蒸馏水于两支试管中,然后同时加入10mL0.1mol/LH2SO4溶液
前者出现浑浊的时间更短,说明增大Na2S2O3浓度,可以加快反应速率
B
探究压强对化学反应速率的影响
在容积不变的密闭容器中发生反应:N2(g)+3H2(g)2NH3(g)向其中通入氩气
反应速率不变,说明化学反应速率不受压强影响
C
探究温度对化学平衡的影响
将装有NO2和N2O4混合气体的连同球分别浸泡在冰水和热水中:2NO2(g)(红棕色)N2O4(g)(无色),△H<0
热水中气体颜色深,冰水中颜色浅,说明其他条件不变时,升高温度,会使化学平衡向吸热方向移动
D
探究KI与FeCl3反应的限度
取5mL0.1mol/L的KI溶液于试管中,加入1mL0.1mol/L的FeCl3溶液,充分反应后滴入5滴15%KSCN溶液
溶液变血红色,则KI与FeCl3的反应有一定限度
A、A B、B C、C D、D -
3、白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验。
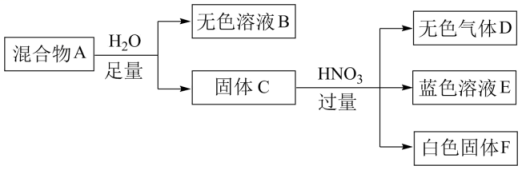
下列推断不正确的是( )
A、无色溶液B做焰色反应实验,火焰可能显紫色 B、白色固体F的主要成分是H2SiO3 C、混合物A中一定含有Na2SiO3、CuSO4和CaCO3 D、在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3 , 若有白色沉淀生成,说明混合物A中有KCl -
4、是离子晶体,具有反萤石结构,晶胞如图所示,其晶格能可通过图中的循环计算得到。
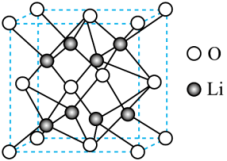

下列说法错误的是( )
A、Li的第一电离能为 B、Li的配位数为4 C、晶格能为 D、晶胞参数为anm,则的密度为 -
5、向和的混合物中加入某浓度的稀硝酸 , 固体物质完全反应,得到标准状况下和的混合气体及。在所得溶液中加入的NaOH溶液 , 此时溶液呈中性,金属离子已完全沉淀,沉淀质量为。下列有关说法正确的是( )A、与的物质的量之比为 B、硝酸的物质的量浓度为2.4mol/L C、产生的的体积为 (标况) D、、与硝酸反应后剩余为
-
6、电解液来源丰富、成本低廉的新型酸碱混合锌铁液流电池的示意图如图,下列说法错误的是( )
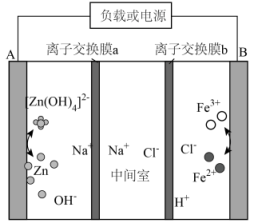 A、放电时,电流由B经导线流向A B、放电时,负极反应式为 C、离子交换膜a为阳离子交换膜 D、充电时,每转移电子,参与反应的铁元素质量为
A、放电时,电流由B经导线流向A B、放电时,负极反应式为 C、离子交换膜a为阳离子交换膜 D、充电时,每转移电子,参与反应的铁元素质量为 -
7、将溶液滴加到己二酸溶液中,混合溶液的与离子浓度变化的关系如图所示。下列叙述错误的是( )
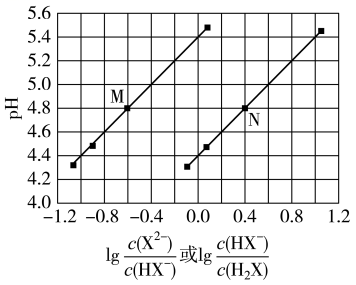 A、当混合溶液呈中性时, B、曲线表示与的变化关系 C、溶液中 D、的数量级为
A、当混合溶液呈中性时, B、曲线表示与的变化关系 C、溶液中 D、的数量级为 -
8、下列溶液中,加入(或通入)某物质后,发生反应的先后顺序正确的是( )A、在含等浓度的Fe3+、H+、Cu2+的溶液中加入铁粉: Fe3+、H+、Cu2+ B、在含等浓度的I-、S2-、Br-的溶液中不断通入氯气:I-、Br-、S2- C、在含等浓度的AlO、CO、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO、CO D、在含等浓度的Mg2+、H+、NH的溶液中逐渐加入烧碱溶液:Mg2+、NH、H+
-
9、与在不同催化剂作用下反应生成的反应历程图(为过渡态。*表示吸附在催化剂表面的物种)如图所示。下列说法正确的是( )
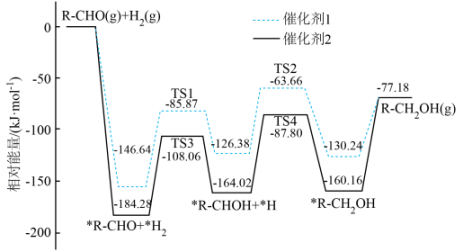 A、该反应为放热反应 B、催化剂1和催化剂2均降低了反应的焓变 C、反应过程中有非极性键的断裂和形成 D、催化剂1作用下的决速步为
A、该反应为放热反应 B、催化剂1和催化剂2均降低了反应的焓变 C、反应过程中有非极性键的断裂和形成 D、催化剂1作用下的决速步为 -
10、以、为原料合成涉及的反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
在5MPa下,按照投料,平衡时,CO和在含碳产物中物质的量分数及的转化率随温度的变化如图。下列说法正确的是( )
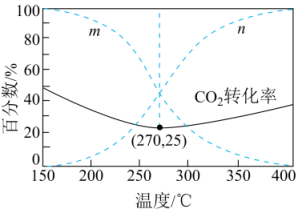 A、反应Ⅲ中反应物的总键能大于生成物的总键能 B、曲线代表CO在含碳产物中物质的量分数 C、该条件下温度越低,越有利于工业生产 D、图示270℃时,平衡体系中的体积分数约为66.6%
A、反应Ⅲ中反应物的总键能大于生成物的总键能 B、曲线代表CO在含碳产物中物质的量分数 C、该条件下温度越低,越有利于工业生产 D、图示270℃时,平衡体系中的体积分数约为66.6% -
11、常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、使酚酞试液呈红色的溶液中:、、、 B、水电离的mol⋅L的溶液中:、、、 C、明矾溶液中:、、、 D、的溶液中:、、、
-
12、金属M在潮湿的空气中会形成一层致密稳定的3M(XY)2•MZX3 , X、Y、Z为短周期主族元素,X的原子序数是Y的8倍,基态X和Z的未成对电子数相同,M是人体必需的元素之一。1molMZX3 , 含有42mol质子,下列说法正确的是( )A、离子半径:M>X B、X、Y、Z的电负性大小为:X>Z>Y C、M的最高价氧化物对应水化物为强碱 D、第一电离能:Z>X
-
13、下列离子方程式书写正确的是( )A、白醋与次氯酸钠溶液混合产生黄绿色气体: B、四氧化三铁溶于足量稀硝酸: C、向溶液中通入过量: D、向氯化铝溶液中加入过量浓氨水:
-
14、下列根据实验现象得出结论不正确的是( )A、氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 B、向溴水中通入SO2 , 溶液褪色,说明SO2具有漂白性 C、向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ D、向SO2水溶液中加入NaHCO3粉末,有气泡产生,说明H2SO3酸性强于H2CO3
-
15、下列说法不正确的是( )A、做“海带中碘元素的分离及检验”实验时,须用过量的氯气或双氧水氧化I- B、冷却结晶时,溶液冷却得越快,析出的晶体颗粒就越小 C、其他条件相同时,双氧水在碱性溶液中分解速率比在酸性溶液中快 D、如果酸液溅入眼内,用大量水冲洗后,立即送医院诊治
-
16、官能团决定有机物的化学特性。下列有机物中,既能使溴水褪色又能跟金属钠反应,还可以和碳酸钠溶液反应的是( )A、CH2=CHCH2OH B、CH2CHCHO C、CH2=CHCOOH D、CH2=CHCOOCH3
-
17、为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,中含有的氯原子数为 B、溶液中的数目为 C、密闭容器中,和在催化剂作用下充分反应后分子总数为 D、1molNa与足量反应生成和的混合物,转移的电子数为
-
18、下列有关说法正确的是( )A、钢铁发生电化学腐蚀的负极反应式: B、用Pt电极电解一定量的稀硫酸溶液,电解一段时间后溶液的pH值不变 C、电解精炼铜时,电解质溶液中均保持不变 D、金属Cu无论在酸性条件下,还是在碱性条件下发生的都是吸氧腐蚀
-
19、下列各组物质中,按沸点由低到高的顺序排列正确的是( )A、H2O、H2S、H2Se、H2Te B、CH4、CCl4、CBr4、CI4 C、金刚石、P4、O2 D、碳化硅、二氧化硅、晶体硅
-
20、胶体有别于其他分散系的本质区别是( )A、分散质粒子大小在1~100 nm B、能透过滤纸 C、电泳 D、丁达尔效应