-
1、芳基亚胺酯是重要的有机反应中间体,受热易分解,可由腈在酸催化下与醇发生Pinner反应制各,原理如下图所示。
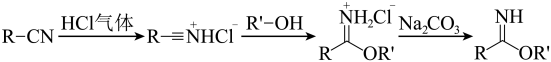
某实验小组以苯甲腈(
 , )和三氟乙醇( , ) 为原料合成苯甲亚胺三氟乙脂。步骤如下:
, )和三氟乙醇( , ) 为原料合成苯甲亚胺三氟乙脂。步骤如下:I.将苯甲腈与三氟乙醇置于容器中,冰浴降温至。
Ⅱ.向容器中持续通入气体4小时,密封容器。
Ⅲ.室温下在氛围中继续搅拌反应液24小时,冷却至 , 抽滤得白色固体,用乙腈洗涤。
IV.将洗涤后的白色固体加入饱和溶液中,低温下反应,有机溶剂萃取3次,合并有机相。
V.向有机相中加入无水 , 过滤,蒸去溶剂得产品。
回答下列问题:
(1)、实验室中可用浓盐酸和无水制备干燥气体,下列仪器中一定需要的为(填仪器名称)。 (2)、第Ⅱ步通气完毕后,容器密封的原因为。(3)、第Ⅲ步中得到的白色固体主要成分为。
(2)、第Ⅱ步通气完毕后,容器密封的原因为。(3)、第Ⅲ步中得到的白色固体主要成分为。 (4)、第IV步中选择低温的原因为。(5)、第IV步萃取时可选用的有机溶剂为____。A、丙酮 B、乙酸 C、乙酸乙酯 D、甲醇(6)、第V步中无水的作用为。(7)、本实验的产率为。
(4)、第IV步中选择低温的原因为。(5)、第IV步萃取时可选用的有机溶剂为____。A、丙酮 B、乙酸 C、乙酸乙酯 D、甲醇(6)、第V步中无水的作用为。(7)、本实验的产率为。 -
2、是一种重要的含锶化合物,广泛应用于许多领域。以天青石(主要成分为)为原料制备的一种工艺方法如下:

天青石主要元素质量分数如下:
元素
质量分数()
36.4
2.0
4.0
0.5
5.0
。
回答下列问题:
(1)、天青石与碳粉在一定投料比下“煅烧”生成和碳氧化物,据矿样成分分析结果计算得出,生成、时失重率分别为、 , 实际热重分析显示失重率为32.6%,则“煅烧”中主要生成的碳氧化物为(填“”或“”)。(2)、“煅烧”过程中还可能产生少量对环境有危害的气体,化学式为和。(3)、“水浸”后滤渣的主要成分除和C外,还有两种氧化物,化学式为和。(4)、“水浸”时需加热,与热水作用后的溶液呈碱性的主要原因为(用化学方程式表示)(5)、“水浸”后的滤液中 , “除杂”过程中(忽略溶液引起的体积变化),为使不沉淀,应控制溶液中 , 每升滤液中篇加入溶液的体积。(6)、“沉锶”过程中,可溶性发生反应的离子方程式为。 -
3、室温下,向、均为的混合溶液中持续通入气体,始终保持饱和(的物质的量浓度为),通过调节使、分别沉淀,溶液中与的关系如下图所示。其中,c表示、、和的物质的量浓度的数值,。下列说法错误的是( )
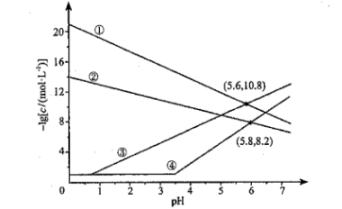 A、①代表与的关系曲线 B、逐渐增大时,溶液中优先析出的沉淀为 C、的 D、的平衡常数
A、①代表与的关系曲线 B、逐渐增大时,溶液中优先析出的沉淀为 C、的 D、的平衡常数 -
4、某生物质电池原理如下图所示,充、放电时分别得到高附加值的醇和羧酸。下列说法正确的是( )
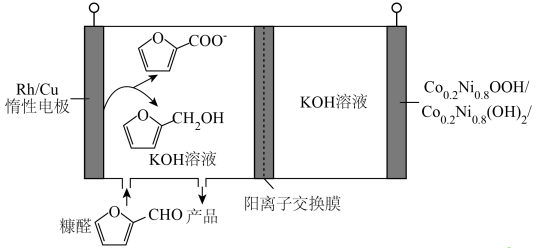 A、放电时,正极电极反应为:
A、放电时,正极电极反应为: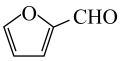 +H2O-2e-=
+H2O-2e-=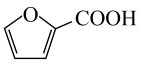 +2H+
B、放电时,转化为
C、充电时,通过交换膜从左室向右室迁移
D、充电时,阴极电极反应为:
+2H+
B、放电时,转化为
C、充电时,通过交换膜从左室向右室迁移
D、充电时,阴极电极反应为: +2H2O+2e-=
+2H2O+2e-=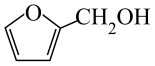 +2OH-
+2OH-
-
5、下列各组实验所得结论或推论正确的是( )
实验现象
结论或推论
A
向某有机物()中滴加溶液,显色
该有机物分子中含酚羟基
B
向酸性高锰酸钾溶液中加入甲苯,紫色褪去
甲苯同系物均有此性质
C
向银氨溶液中滴加某单糖溶液,形成银镜
该糖属于还原糖
D
测得两溶液导电能力相同
两溶液物质的量浓度相等
A、A B、B C、C D、D -
6、实验室合成高铁酸钾()的过程如下图所示。下列说法错误的是( )
 A、气体a的主要成分为 B、沉淀b的主要成分为 C、中的化合价为 D、反应2为
A、气体a的主要成分为 B、沉淀b的主要成分为 C、中的化合价为 D、反应2为 -
7、如图,b为标准氢电极,可发生还原反应()或氧化反应(),a、c分别为、电极。实验发现:1与2相连a电极质量减小,2与3相连c电极质量增大。下列说法正确的是( )
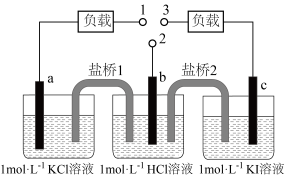 A、1与2相连,盐桥1中阳离子向b电极移动 B、2与3相连,电池反应为 C、1与3相连,a电极减小的质量等于c电极增大的质量 D、1与2、2与3相连,b电极均为流出极
A、1与2相连,盐桥1中阳离子向b电极移动 B、2与3相连,电池反应为 C、1与3相连,a电极减小的质量等于c电极增大的质量 D、1与2、2与3相连,b电极均为流出极 -
8、镍酸镧电催化剂立方晶胞如图所示,晶胞参数为a,具有催化活性的是 , 图①和图②是晶胞的不同切面。下列说法错误的是( )
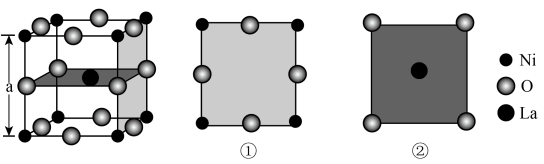 A、催化活性:①>② B、镍酸镧晶体的化学式为 C、周围紧邻的O有4个 D、和的最短距离为
A、催化活性:①>② B、镍酸镧晶体的化学式为 C、周围紧邻的O有4个 D、和的最短距离为 -
9、某离子液体结构如下图所示。W、X、Y、Z原子序数依次增大,W、X和Y的原子序数之和为14,X和Y基态原子的核外未成对电子数之和为5,Z是第四周期元素。下列说法错误的是( )
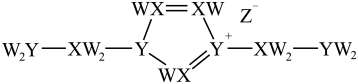 A、X、Z的简单氢化物均可溶于水 B、电负性: C、第一电离能: D、W、Y、Z可形成既含离子键又含共价键的化合物
A、X、Z的简单氢化物均可溶于水 B、电负性: C、第一电离能: D、W、Y、Z可形成既含离子键又含共价键的化合物 -
10、高分子的循环利用过程如下图所示。下列说法错误的是(不考虑立体异构)( )
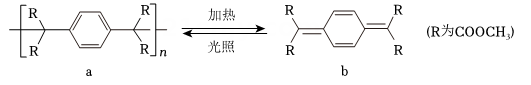 A、b生成a的反应属于加聚反应 B、a中碳原子杂化方式为和 C、a的链节与b分子中氢元素的质量分数不同 D、b与发生加成反应最多可生成4种二溴代物
A、b生成a的反应属于加聚反应 B、a中碳原子杂化方式为和 C、a的链节与b分子中氢元素的质量分数不同 D、b与发生加成反应最多可生成4种二溴代物 -
11、下列化学方程式或离子方程式正确的是( )A、氢氟酸溶蚀石英玻璃: B、盐酸除锅炉水垢: C、溶液吸收电石气中的: D、侯氏制碱法:
-
12、某化合物具有抗癌活性,结构如图所示。下列有关该物质说法错误的是( )
 A、可发生水解反应 B、含有手性碳原子 C、可发生消去反应 D、含有2个酯基
A、可发生水解反应 B、含有手性碳原子 C、可发生消去反应 D、含有2个酯基 -
13、下列各组物质分离提纯方法及依据均正确的是( )
分离提纯方法
依据
A
重结晶法除去苯甲酸中的氯化钠
温度对溶解度的影响不同
B
氢氧化钠溶液洗气法除去中的
化学性质不同
C
分液法分离乙酸正丁酯和正丁醇
沸点不同
D
加热法除去碳酸氢钠固体中的碳酸钠
热稳定性不同
A、A B、B C、C D、D -
14、电解重水()是制取氘气()的一种方法。设为阿伏加德罗常数的值。下列说法错误的是( )A、分子间存在氢键 B、的熔、沸点比高 C、含中子数目为 D、制取转移的电子数目为
-
15、下列化学用语表述正确的是( )A、的空间结构为V形 B、顺二溴乙烯结构式为
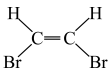 C、的电子式为
D、基态原子价电子排布式为
C、的电子式为
D、基态原子价电子排布式为
-
16、“银朱”主要成分为。《天工开物》记载:“凡将水银再升朱用,故名曰银朱…即漆工以鲜物采,唯(银朱)入桐油则显…若水银已升朱,则不可复还为汞。”下列说法错误的是( )A、“银朱”可由和S制备 B、“银朱”可用于制作颜料 C、“桐油”为天然高分子 D、“水银升朱”不是可逆反应
-
17、春节是中华民族重要的传统节日,近日被确定为联合国假日。以下有关春节习俗中的化学知识说法错误的是( )A、红烧肉烹饪过程中蛋白质变性涉及化学变化 B、春晚演员的彩妆用品均属于无机物 C、饺子与糯米年糕的口感差异与支链淀粉的含量有关 D、陈年老酒的芳香气味与酯的形成有关
-
18、多丁纳德(化合物K)是一种治疗痛风的药物,以下为其合成路线之一(部分反应条件已简化)。

已知:

回答下列问题:
(1)、B的化学名称是。(2)、D中官能团的名称为、。(3)、由F和H反应生成I的化学方程式为 , 反应类型为。(4)、由I转变为J可选用的试剂是____(填标号)。A、 B、
B、 C、稀
D、溶液
(5)、设计反应1和反应2的目的是。(6)、在D的同分异构体中,同时满足下列条件的共有种;
C、稀
D、溶液
(5)、设计反应1和反应2的目的是。(6)、在D的同分异构体中,同时满足下列条件的共有种;①含有苯环;②遇溶液显紫色;③与溶液反应放出。
其中,核磁共振氢谱显示为五组峰,且峰面积比为的同分异构体的结构简式为。
-
19、二氧化碳一甲烷重整反应制备合成气(H2+CO)是一种生产高附加值化学品的低碳过程。该过程存在如下化学反应:
①
②
③
④
回答下列问题:
(1)、 , 反应①正向自发进行(填标号)。A.低温下能 B.高温下能 C.任何温度下都能 D.任何温度下都不能
(2)、反应体系总压强分别为和时,平衡转化率随反应温度变化如图所示,则代表反应体系总压强为的曲线是(填“Ⅰ”“Ⅱ”或“Ⅲ”),判断依据是。 (3)、当反应体系总压强为时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,的物质的量先增加后减少,主要原因是。
(3)、当反应体系总压强为时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,的物质的量先增加后减少,主要原因是。 (4)、恒温恒压条件下,向容器中通入和 , 达到平衡时的转化率为的转化率为 , 碳单质的物质的量为的物质的量为 , 反应①用摩尔分数表示的平衡常数(结果保留两位小数)。
(4)、恒温恒压条件下,向容器中通入和 , 达到平衡时的转化率为的转化率为 , 碳单质的物质的量为的物质的量为 , 反应①用摩尔分数表示的平衡常数(结果保留两位小数)。上述平衡时 , 向体系通入气,重新达到平衡时, , 则ab(填“>”“<”或“=”)。(已知反应的 , 物质的摩尔分数)
-
20、钢渣是钢铁行业的固体废弃物,含有和等物质。一种以钢渣粉为原料固定并制备的工艺流程如图所示。
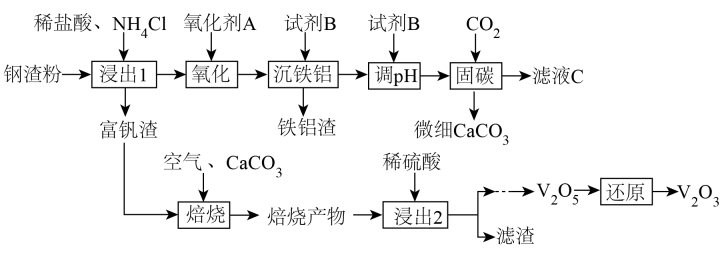
已知钢渣中元素质量分数为在稀盐酸和混合溶液中不易被浸出。该工艺条件下,有关金属离子开始沉淀和沉淀完全的如下表所示:
金属离子
开始沉淀的
1.9
7.2
3.5
12.4
沉淀完全的
2.9
8.2
5.1
13.8
回答下列问题:
(1)、浸出1过程生成的“包裹”在钢渣表面形成固体膜,阻碍反应物向钢渣扩散。提高浸出率的措施有(除粉碎外,举1例)。该浸出过程不使用稀硫酸代替稀盐酸的原因是。(2)、为避免引入杂质离子,氧化剂应为(举1例)。(3)、滤液的溶质可循环利用,试剂应为。(4)、若的浸出率为 , 理论上1吨钢渣在“固碳”中可固定。(5)、富钒渣焙烧可生成钒钙盐,不同钒钙盐的溶解率随变化如图所示。已知浸出2的pH约为2.5,则应控制焙烧条件使该钒钙盐为。该培烧反应的化学方程式是。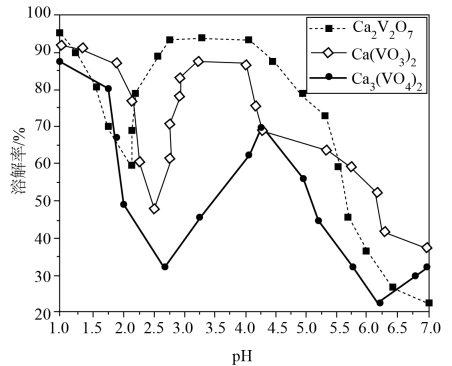 (6)、微细碳酸钙广泛应用于医药、食品等领域,某种碳酸钙晶胞如图所示。已知 , 该晶体密度为(列出计算式,阿伏加德罗常数的值为)。
(6)、微细碳酸钙广泛应用于医药、食品等领域,某种碳酸钙晶胞如图所示。已知 , 该晶体密度为(列出计算式,阿伏加德罗常数的值为)。