-
1、下列表示方法或说法正确的是( )A、甲烷分子的球棍模型:
 B、次氯酸的结构式为
C、的电子式:
D、中子数为2的氢原子:
B、次氯酸的结构式为
C、的电子式:
D、中子数为2的氢原子:
-
2、实验室利用固体配制的溶液时,下列说法或做法正确的是( )A、用滤纸称量固体 B、溶解后没有冷却便进行定容 C、定容时俯视刻度线会使所配溶液的浓度偏高 D、将容量瓶振荡摇匀后发现液面低于刻度线,又加水至刻度线
-
3、短周期主族元素X、Y、A、B、C在元素周期表中的位置如图所示,A是非金属性最强的元素,则下列说法错误的是( )
 A、Y的最高价氧化物对应的水化物是一种强酸 B、A、B的氢化物的沸点顺序为 C、原子半径由小到大的顺序为 D、B、C简单离子的还原性由弱到强的顺序为
A、Y的最高价氧化物对应的水化物是一种强酸 B、A、B的氢化物的沸点顺序为 C、原子半径由小到大的顺序为 D、B、C简单离子的还原性由弱到强的顺序为 -
4、酸式盐是盐的一种,可看作多元酸中的氢离子未被完全中和所得到的盐,常见的有等.已知(亚磷酸)与足量的充分反应后只生成一种盐 , 则下列说法错误的是( )A、属于一元酸 B、属于酸式盐 C、溶液显碱性 D、在水溶液中的电离方程式为
-
5、常温下稀溶液中,下列操作能使增大的是( )A、加水稀释 B、加入几滴稀 C、加入适量 D、加热
-
6、水的电离平衡曲线如图所示,下列说法正确的是( )
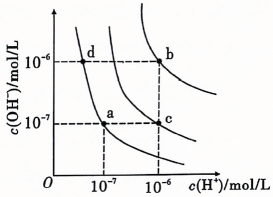 A、纯水仅升高温度,可从a点变到c点 B、水的电离常数数值大小关系为 C、a点温度下,在水中加入少量的醋酸钠可抑制水的电离 D、c点 , 溶液为酸性
A、纯水仅升高温度,可从a点变到c点 B、水的电离常数数值大小关系为 C、a点温度下,在水中加入少量的醋酸钠可抑制水的电离 D、c点 , 溶液为酸性 -
7、运用思维图学习,有助于提高归纳整理能力.如图为物质X的思维图,X为( )
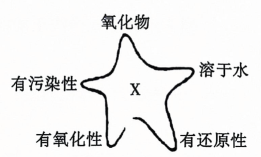 A、S B、 C、 D、
A、S B、 C、 D、 -
8、下列物质的用途与盐的水解无关的是( )A、配置溶液时,需要加入少量的粉 B、用明矾净水 C、草木灰和铵态氮肥不能混合使用 D、用和大量水反应,同时加热制备
-
9、下列描述的反应中产物的总能量高于反应物的总能量的是( )
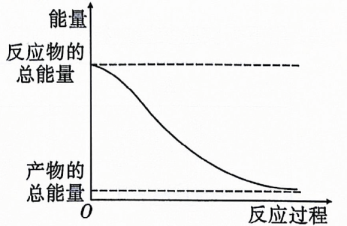 A、金属与稀盐酸的反应 B、高温分解 C、溶于水 D、能量变化如图所示的化学反应
A、金属与稀盐酸的反应 B、高温分解 C、溶于水 D、能量变化如图所示的化学反应 -
10、下列物质能导电且属于电解质的是( )A、冰醋酸 B、 C、饱和食盐水 D、熔融的硫酸钡
-
11、化学反应常伴随热效应.某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式计算获得.(1)、盐酸浓度的测定:用溶液测定未知浓度的盐酸,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取盐酸 , 注入锥形瓶中,加入酚酞作指示剂
D.另取锥形瓶,再重复操作次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准溶液润洗后,将标准液注入碱式滴定管“0”刻度以上处,调节液面至“0”刻度或“0”刻度以下,再把碱式滴定管固定好
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定时正确的操作顺序是(填序号)E→→F→→C→→D.
②上述滴定操作用到的仪器有(填序号).

③滴定时边滴边摇动锥形瓶,眼睛应注意观察 . 滴定终点溶液颜色的变化是 .
④滴定结果如下表所示:
滴定次数
待测液体积/
标准溶液的体积/
滴定前读数
滴定后读数
1
20.00
1.03
23.03
2
20.00
0.60
22.60
3
20.00
0.20
20.19
则该盐酸浓度为 .
⑤若碱式滴定管用蒸馏水洗净后,未经标准液润洗就注入标准溶液,则测定结果将(填“偏高”“偏低”或“不变”).
(2)、热量的测定:取上述溶液和盐酸各进行反应,测得反应前后体系的温度值(℃)分别为 , 则该过程放出的热量为J(c和ρ分别取和 , 忽略水以外各物质吸收的热量). -
12、我国提出2060年达“碳中和”目标.(1)、Ⅰ.还原是实现“双碳”经济的有效途径之一,相关的主要反应有:
①
②
请回答:
有利于提高平衡转化率的条件是____(填序号).A、低温低压 B、低温高压 C、高温低压 D、高温高压(2)、反应的 , (用表示).(3)、恒压、时,和按物质的量之比投料,反应经如图所示流程(主要产物已标出)可实现高效转化.
下列说法正确的是____(填序号).
A、过程ii,吸收可促使氧化的平衡正移 B、过程ii产生的最终未被吸收,在过程iii被排出 C、可循环利用,不可循环利用 D、相比于反应①,该流程的总反应还原需吸收的能量更多(4)、Ⅱ.近年研究发现,电催化和含氮物质(等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题.向一定浓度的溶液通至饱和,在电极上反应生成 , 电解原理如图所示.
电极b是电解池的极,电极反应式为 .
(5)、电解过程中生成尿素的电极反应式是 . -
13、可作为紫外线吸收剂应用于化妆品中.某工厂采用如图所示工艺处理工厂废渣(主要成分为 , 另含少量等)制取高纯 . 回答下列问题:
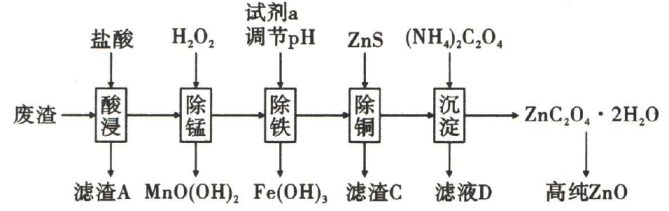
已知:①草酸受热易分解生成;
②常温下: .
(1)、提高酸浸速率的措施有(写一条即可).(2)、“滤渣A”的主要成分为 .(3)、的电子式为 .(4)、试剂a为 , “滤液D”中主要含有的离子有 .(5)、写出“除锰”中,生成的离子方程式: .(6)、写出由制得氧化锌的化学方程式: .(7)、“除锰”后滤液中 , “除铁”操作中可以调节的范围是 . -
14、食醋是烹饪美食的调味品,有效成分主要为乙酸,回答下列问题:(1)、乙酸俗称醋酸,乙酸可凝结为类似冰一样的晶体,又叫 , 乙酸的官能团是(写名称).(2)、实验室常用图装置制备乙酸乙酯.

①a试管中装有乙酸、无水乙醇、浓硫酸,b试管中液体是 , 浓硫酸的作用是 , a试管中主要反应的化学方程式为 .
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是 .
(3)、醋酸能除水垢 , 写出该反应的离子方程式: .(4)、 , 将的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).①;②;③ .
(5)、室温下,醋酸溶液 , 则该温度下醋酸电离平衡常数 , 约为 . -
15、常温下,向相同体积、相同浓度的和溶液中分别滴加的盐酸,溶液变化如图所示,下列说法正确的是( )
 A、图甲是的滴定曲线 B、A、B、C均满足: C、水的电离程度: D、点溶液中的微粒满足关系式:
A、图甲是的滴定曲线 B、A、B、C均满足: C、水的电离程度: D、点溶液中的微粒满足关系式: -
16、时将和充入容积为的恒容密闭容器中,发生反应后达到平衡,B的转化率为50%.若温度不变,将容器的容积缩小为原来的一半,A的转化率不发生变化.下列说法正确的是( )A、 B、该温度下,此反应达平衡时的化学平衡常数 C、内 D、平衡后,若升高温度,重新达到平衡,A的转化率减小
-
17、下列说法正确的是( )A、为了配制浓度与的浓度比为的溶液,可在溶液中加入适量的盐酸 B、溶于的离子方程式: C、中和相同、相同体积的溶液和氨水,消耗盐酸中的物质的量相同 D、氨水和溶液等体积混合后所得溶液 , 则
-
18、下列实验、现象及结论都正确的是( )
选项
实验
现象
结论
A
用试纸测定“84”消毒液的
试纸最终显蓝色
在溶液中水解显碱性
B
向盛有溶液的试管中滴加2滴硝酸银溶液,震荡试管,然后向其中滴加4滴溶液
先产生白色沉淀,然后白色沉淀转化为黄色沉淀
C
向溶液中滴加溶液
溶液褪色
具有氧化性
D
向溶液中通入和X气体
产生白色沉淀
气体X一定具有强氧化性
A、A B、B C、C D、D -
19、在空气中与的反应是分两步完成的,其反应过程如图所示,下列有关说法错误的是( )
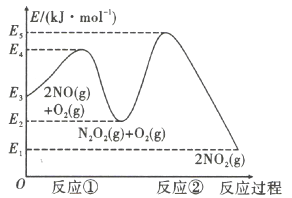 A、反应①的方程式为 , 且为放热反应 B、反应的活化能为 C、第二步反应是该反应的决速步骤 D、如果加入合适的催化剂,可以改变该反应的
A、反应①的方程式为 , 且为放热反应 B、反应的活化能为 C、第二步反应是该反应的决速步骤 D、如果加入合适的催化剂,可以改变该反应的 -
20、短周期主族元素a、b、c、d原子序数依次增大,d是短周期中金属性最强的元素,c是地壳中含量最多的元素,只有b、c处于同一周期且相邻.下列说法错误的是( )A、原子半径: B、d的最高价氧化物对应的水化物是一种强碱 C、c的单质的氧化性比b的强 D、a、b、c三种元素可以组成共价化合物和离子化合物