-
1、管道工人利用反应:检验氯气管道是否漏气。关于该反应下列说法正确的是( )A、每生成1 mol , 转移6 mol电子 B、既是氧化产物又是还原产物 C、发生氧化反应,发生还原反应 D、被氧化的与被还原的的分子数之比为8∶3
-
2、下列图示与对应的叙述相符的是( )(夹持装置已略去)


注:烧瓶中为和的混合气体


A.制备氢氧化铁胶体
B.验证温度对化学平衡的影响
C.中和反应反应热的测定
D.定量测定化学反应速率
A、A B、B C、C D、D -
3、设为阿伏加德罗常数的值,下列说法正确的是( )A、11.2 L含有的质子数为 B、1 mol⋅L 溶液中含有硝酸根离子的数目为 C、常温下,将5.6 g铁投入足量的浓硫酸中,转移电子数为 D、1 mol金属钠在氧气中完全燃烧生成 , 失去的电子数目为
-
4、下列化学用语正确的是( )A、的结构示意图:
 B、硫酸的电离方程式为:
C、水的电子式:
D、甲烷分子的空间填充模型:
B、硫酸的电离方程式为:
C、水的电子式:
D、甲烷分子的空间填充模型:
-
5、化学与工业、农业生产和日常生活密切相关。下列叙述错误的是( )A、塑料的合成原料来自石油,“禁塑令”的颁布有利于减少的排放 B、华为手机Mate30的芯片麒麟990主要原材料是硅 C、铁路建设所需的大量水泥属于新型无机非金属材料 D、豆科植物根瘤菌可以在常温常压下把N₂转化为氮的化合物
-
6、高铁酸钾是一种高效净水剂.已知:易溶于水,微溶于浓溶液;在酸性或中性溶液中不稳定,在的强碱性溶液中较稳定.如图所示某实验小组欲制备高铁酸钾并测定其纯度.
 (1)、盛放浓盐酸的仪器名称为 , 装置A中发生反应时,每生成消耗的高锰酸钾的物质的量为 .(2)、将除杂装置B补充完整并标明所用试剂.(3)、装置C中与反应生成的化学方程式为 .(4)、实验时将装置C置于冰水浴中,其原因是 .(5)、实验后经结晶法得到的晶体仍含较多杂质,要得到更纯的晶体,还应采取的操作方法是 .(6)、将粗产品溶于过量的碱性亚铬酸盐溶液中,充分反应后,加入稀硫酸酸化至为2,在所得的重铬酸盐溶液中加入5滴二苯胺磺酸钠溶液作指示剂,然后用标准溶液滴定至终点,消耗标淮溶液 . 已知该过程中涉及的离子反应主要有三个:
(1)、盛放浓盐酸的仪器名称为 , 装置A中发生反应时,每生成消耗的高锰酸钾的物质的量为 .(2)、将除杂装置B补充完整并标明所用试剂.(3)、装置C中与反应生成的化学方程式为 .(4)、实验时将装置C置于冰水浴中,其原因是 .(5)、实验后经结晶法得到的晶体仍含较多杂质,要得到更纯的晶体,还应采取的操作方法是 .(6)、将粗产品溶于过量的碱性亚铬酸盐溶液中,充分反应后,加入稀硫酸酸化至为2,在所得的重铬酸盐溶液中加入5滴二苯胺磺酸钠溶液作指示剂,然后用标准溶液滴定至终点,消耗标淮溶液 . 已知该过程中涉及的离子反应主要有三个:①;
②;
③ .
该粗产品中的质量分数为(用含w、c、V的代数式表示),若滴定管没有用标准液润洗,则测得的结果(填“偏高”“偏低”或“无影响”).
-
7、氮及其化合物在生产、生活中有广泛的应用,请结合信息回答下列问题:(1)、尿素是首个由无机物人工合成的有机物,在尿素合成塔中发生的反应可表示为第一步:;
第二步: .
则 .
第二步能自发进行的条件是(填“高温”“低温”或“任何温度”).
(2)、 , 在的密闭容器中,通入和 , 保持体积不变发生反应:时反应刚好达到平衡,此时的物质的量为 , 则:①的平均反应速率 .
②下列能说明上述反应达到平衡状态的是(填序号).
A.混合气体的密度不再发生变化
B.
C.的体积分数在混合气体中保持不变
D.单位时间内消耗的同时生成
(3)、温度为时,在一个容积恒为的密闭容器中仅发生反应: . 实验测得:为速率常数,受温度影响.相关物质的起始浓度与平衡浓度如下表所示:物质的起始浓度/
物质的平衡浓度/
0.6
0.3
0
0.2
温度为时,(填数据);当温度升高为时,分别增大m倍和n倍,则mn(填“>”“<”或“=”).
(4)、时,在密闭容器中按照一定比例充入和 , 仅发生反应: , 达到平衡时的体积分数随的变化如图所示,当时,达到平衡时可能是D、E、F三点中的 .
-
8、钴在硬质高温合金、催化剂等高新技术领域有广泛应用.从某炼锌厂的废渣(含等)中回收钴的一种工艺流程如图所示:

相关金属离子形成氢氧化物沉淀的范围如下表:
金属离子
开始沉淀的
7.15
6.3
1.5
6.2
沉淀完全的
9.15
8.3
2.8
8.2
(1)、酸浸时加热的主要作用为 .(2)、若无“氧化”步骤,对实验的影响是 .(3)、试剂X可以为下列物质中的(填序号),“调除铁”时应该调节的范围为 .A. B. C. D.
(4)、从流程信息分析,在有机溶剂M中,(填“”或“”)的溶解度更大.(5)、操作2的实验步骤为、、过滤、洗涤、干燥.(6)、工业上利用将氧化成沉淀实现的回收,该反应的离子方程式为 . -
9、请根据所学知识回答下列问题:(1)、“84”消毒液是一种以为主要成分的高效消毒剂,溶液呈性(填“酸”“碱”或“中”),原因可用离子方程式表示为 .(2)、时,为3的硫酸铝溶液中,由水电离出的为 . 该温度下,若的100体积某强酸溶液与的1体积某强碱溶液混合后溶液呈中性,则 .(3)、向浓度均为的和混合液中滴加碳酸铵溶液至生成两种沉淀,则溶液中 . [已知:、](4)、相同条件下,下列溶液中,由小到大的排列顺序是(填序号).
A. B. C. D.
(5)、现用溶液组成的燃料电池,采用电解法制备 , 装置如图所示.石墨Ⅱ电极为(填“正极”或“负极”),写出石墨Ⅰ电极上发生反应的电极反应式: . 在电解池中生成的电极反应式为 .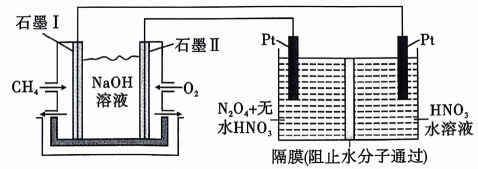
-
10、常温下,将溶液分别滴加到浓度均为的溶液中,所得的沉淀溶解平衡曲线如图所示(用表示,不考虑的水解).下列叙述正确的是( )
 A、M代表与的变化关系 B、的数量级为 C、d点对应的溶液为不饱和溶液 D、平衡常数为 , 反应趋于完全
A、M代表与的变化关系 B、的数量级为 C、d点对应的溶液为不饱和溶液 D、平衡常数为 , 反应趋于完全 -
11、某温度下,将和置于恒容密闭容器中发生反应: , 下列对如图所示图像的说法正确的是( )
 A、达平衡后,其他条件不变,若增大容器容积,则反应速率变化图像可以用图甲表示 B、其他条件相同时,不同温度下转化率与温度的关系如图乙,则 C、由图丙推断,A点对应温度下该反应的平衡常数为800 D、由图丙推断,B点的平衡浓度为
A、达平衡后,其他条件不变,若增大容器容积,则反应速率变化图像可以用图甲表示 B、其他条件相同时,不同温度下转化率与温度的关系如图乙,则 C、由图丙推断,A点对应温度下该反应的平衡常数为800 D、由图丙推断,B点的平衡浓度为 -
12、锂离子电池具有比能量大、用途广等特点.如图所示为一种锂离子电池的结构示意图,电池反应式为 . 下列说法错误的是( )
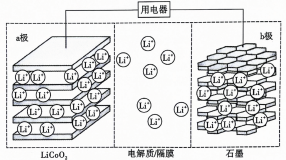 A、放电时,b极发生的电极反应式为 B、充电时a极接外电源的正极 C、放电时电解质中数目减少 D、充电时若转移电子,a电极将减轻
A、放电时,b极发生的电极反应式为 B、充电时a极接外电源的正极 C、放电时电解质中数目减少 D、充电时若转移电子,a电极将减轻 -
13、已知常温下的电离平衡常数;的电离平衡常数 . 下列说法错误的是( )A、浓度为的溶液中: B、酸性: C、稀释溶液,增大 D、常温下,用溶液吸收 , 当溶液呈中性时,
-
14、用下列实验装置进行相应实验,操作错误或不能达到预期目的的是( )
A
B
C
D




测定酸碱中和的热效应
碱式滴定管排气泡
测定与反应速率
测定盐酸的
A、A B、B C、C D、D -
15、乙烯在酸催化下与水制乙醇的反应机理及反应进程中能量的变化如图甲、乙所示.下列叙述错误的是( )
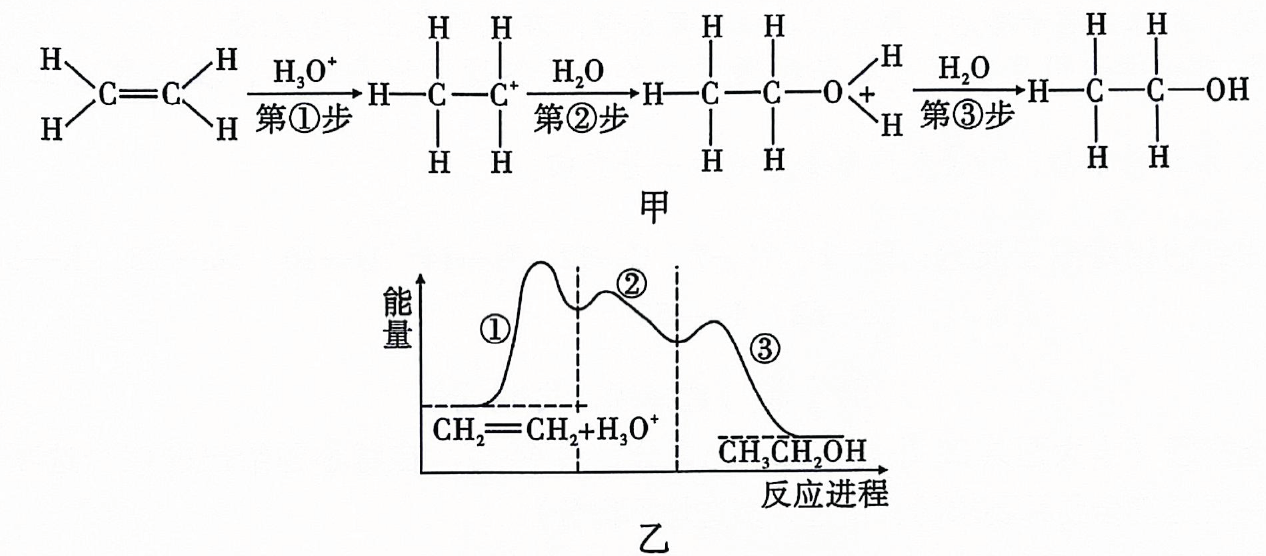 A、乙烯中既含有极性共价键又含有非极性共价键 B、第①步反应的活化能最大 C、酸催化剂加快了化学反应速率,降低了该反应的反应热 D、第③步反应为
A、乙烯中既含有极性共价键又含有非极性共价键 B、第①步反应的活化能最大 C、酸催化剂加快了化学反应速率,降低了该反应的反应热 D、第③步反应为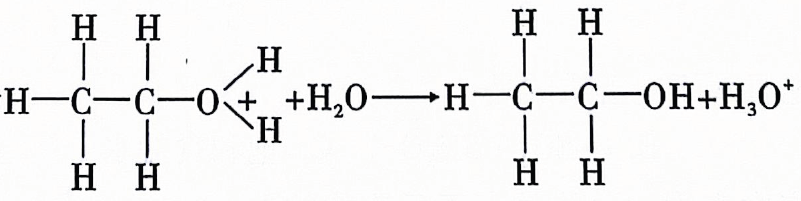
-
16、下列溶液的酸碱性或离子浓度关系表示正确的是( )A、溶液中: B、常温下的与的溶液等体积混合后的溶液中: C、的溶液中: D、物质的量浓度相等的和溶液等体积混合后的溶液中:
-
17、柑橘类水果中含有柠檬酸,其结构简式如图所示,下列有关说法错误的是( )
 A、分子式是 B、可以发生取代反应、加聚反应、酯化反应 C、能与反应生成 D、该有机物最多可消耗
A、分子式是 B、可以发生取代反应、加聚反应、酯化反应 C、能与反应生成 D、该有机物最多可消耗 -
18、用还原法可以将硝酸厂烟气中的大量氮氧化物转化为无害物质.常温下,将与的混合气体通入与的混合溶液中,其物质的转化过程如图所示.下列说法错误的是( )
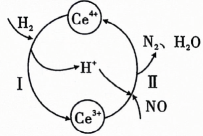 A、反应Ⅰ的离子方程式为 B、反应Ⅱ中氧化剂与还原剂的物质的量之比为 C、是无色气体,遇空气迅速变为红棕色 D、反应过程中,混合溶液中和的总数一定保持不变
A、反应Ⅰ的离子方程式为 B、反应Ⅱ中氧化剂与还原剂的物质的量之比为 C、是无色气体,遇空气迅速变为红棕色 D、反应过程中,混合溶液中和的总数一定保持不变 -
19、下列图像表达正确的是( )
 A、微粒电子数 B、两份等量的锌粉与过量的盐酸反应 C、铁片上镀锌 D、浓硫酸的稀释
A、微粒电子数 B、两份等量的锌粉与过量的盐酸反应 C、铁片上镀锌 D、浓硫酸的稀释 -
20、常温下,下列各组离子一定能在指定溶液中大量共存的是( )A、能使甲基橙变红的溶液: B、无色透明的溶液: C、的溶液: D、水电离出的的溶液: