-
1、液流式铅蓄电池以可溶性的甲基磺酸铅[(CH3SO3)2Pb]代替硫酸作为电解质,该电池充放电的总反应为2Pb2++2H2O Pb+PbO2+4H+ , 下列说法不正确的是( )A、放电时,电极质量均减小 B、放电时,正极反应是PbO2+4H++2e-=Pb2++2H2O C、充电时,溶液中Pb2+向阴极移动 D、充电时,阳极周围溶液的pH增大
-
2、在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
 A、温度T1>T2 B、该反应在T1时的平衡常数比T2时的小 C、CO合成甲醇的反应为吸热反应 D、处于A点的反应体系从T1变到T2 , 达到平衡时增大
A、温度T1>T2 B、该反应在T1时的平衡常数比T2时的小 C、CO合成甲醇的反应为吸热反应 D、处于A点的反应体系从T1变到T2 , 达到平衡时增大 -
3、某固体混合物X,含有Al2(SO4)3、FeCl3、Na2CO3和CuSO4中的几种,进行如下实验:
①X与水作用有气泡冒出,得到有色沉淀Y和弱碱性溶液Z;
②沉淀Y与NaOH溶液作用,无变化。
下列说法不正确的是( )
A、混合物X中必定含有Na2CO3 , 不含Al2(SO4)3 B、溶液Z中溶质主要是钠盐,且必含NaHCO3 C、灼烧沉淀Y,可能得到黑色物质 D、往溶液Z中加入Cu粉,若不溶解,说明X中不含FeCl3 -
4、一种麻醉剂的分子结构式如图所示。其中,X的原子核只有1个质子;元素Y、Z、W原子序数依次增大,且均位于X的下一周期;元素E的原子比W原子多8个电子。下列说法不正确的是( )
 A、是一种强氧化性酸 B、非金属性: C、中,Z的化合价为价 D、Y、W、E的氢化物中只有极性键
A、是一种强氧化性酸 B、非金属性: C、中,Z的化合价为价 D、Y、W、E的氢化物中只有极性键 -
5、下列事实不能用勒夏特列原理解释的是 ( )A、新制的氯水放置一段时间,溶液的pH会减小 B、在配制硫酸亚铁溶液时往往要加入少量铁粉 C、恒容容器中反应CO(g)+NO2(g)CO2(g)+NO(g) △H<0达到平衡后,升高温度,气体颜色变深 D、增大压强,有利于SO2与O2反应生成SO3
-
6、下列说法正确的是( )A、6C的电子排布式1s22s22py2 , 违反了泡利不相容原理 B、价电子排布为5s25p1的元素位于第五周期第ⅠA族,是p区元素 C、电子排布式(22Ti)1s22s22p63s23p10违反了洪特规则 D、ns电子的能量一定高于(n-1)p电子的能量
-
7、下列溶液一定呈中性的是( )A、pH=6的溶液 B、使石蕊溶液呈紫色的溶液 C、的溶液 D、水电离出的的溶液
-
8、下列说法正确的是( )A、增大压强,活化分子百分数增多,化学反应速率一定增大 B、升高温度,活化分子百分数不一定增大,化学反应速率一定增大 C、增大反应物浓度,活化分子百分数增加,化学反应速率增大 D、使用正催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率增大
-
9、下列热化学方程式书写正确的是( )A、2SO2+O22SO3 ΔH=-196.6kJ·mol-1 B、H2(g)+O2(g)=H2O(l) ΔH=-285.8kJ·mol-1 C、2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ D、C(s)+O2(g)=CO2(g) ΔH=393.5kJ·mol-1
-
10、氯及其化合物在工业生产和人类生活中应用广泛。(1)、实验室利用将氯气通入碱液制备NaClO和 , 装置如图所示:

①盛放浓盐酸的仪器名称是 , A中发生反应的化学方程式为。
②用8.7 g 与足量浓盐酸充分反应,生成的质量为。
(2)、C中试管内发生反应反应的离子方程式为:。(3)、实验室可以将氯气通入冷而稀的氢氧化钠溶液获得“84消毒液”,制备“84消毒液”的离子方程式。
(4)、某同学设计实验探究84消毒液的漂白性。
I. 在2 mL 84消毒液中加入2 mL水后,放入红色纸片,观察到纸片慢慢褪色。II.在2 mL 84消毒液中加入2 mL白醋后,放入红色纸片,观察到纸片迅速褪色。
III.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。

已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
①实验I、II现象不同的原因是为。
②实验III中,随时间的变化ORP值不同的原因可能是。
③针对不同物品的消毒,需将84消毒液稀释到不同的浓度。已知某品牌84消毒液中次氯酸钠的质量分数为12.6%,若取该消毒液100 g,加水稀释为8%的溶液,需加水的质量为g。
-
11、根据如图的化学反应框图解图。
已知:粉末化合物A是红棕色,粉末单质B是金属单质
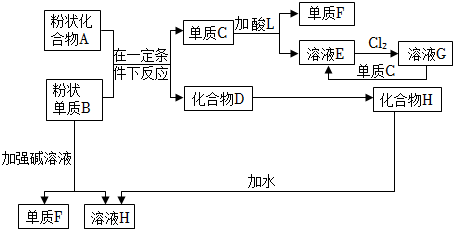 (1)、单质F是 , 溶液E加入氢氧化钠溶液的现象是 ;(2)、写出下列反应的化学方程式:
(1)、单质F是 , 溶液E加入氢氧化钠溶液的现象是 ;(2)、写出下列反应的化学方程式:A+B→C+D ;
D→H:。
(3)、写出下列反应的离子方程式:E+Cl2→G:;
G+C→E:;
B→F+H:。
-
12、高铁酸钠()是一种多功能绿色水处理剂,杀菌消毒的同时可生成氢氧化铁胶体。某工厂利用废金属屑(主要成分为Fe和Cu,含有少量)制取并回收金属Cu,工艺流程如下:
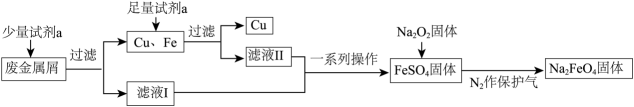 (1)、试剂a为(填化学式)。(2)、用离子方程式解释滤液I不含有可能的原因。(3)、制备的原理:。反应中作还原剂;每生成1 mol 转移电子的物质的量为mol。(4)、高铁酸钠()是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。
(1)、试剂a为(填化学式)。(2)、用离子方程式解释滤液I不含有可能的原因。(3)、制备的原理:。反应中作还原剂;每生成1 mol 转移电子的物质的量为mol。(4)、高铁酸钠()是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。①某兴趣小组欲用固体配制100 mL 的高铁酸钠溶液,需要高铁酸钠固体的质量为g。配制所用的容量瓶上标有、、刻度线。
②下列操作导致浓度偏低的是。
A.容量瓶用蒸馏水洗净之后,直接用于溶液的配制
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.摇匀后,发现液面低于刻度线,又滴加蒸馏水至与刻度线相切
D.定容时,俯视刻度线 -
13、现有下列物质(括号内为对应物质的主要成分):a.熔融NaOH;b.医用酒精;c.蔗糖晶体;d.加碘盐(NaCl和KIO3);e.“84”消毒液(NaClO);f.小苏打(NaHCO3);g.洁厕灵(HCl),回答下列问题:(1)、上述状态下的物质中,属于电解质且能导电的是 (填字母,下同);d和f均为厨房中的常用物质,可用于区分两者的物质是 。(2)、生活中若将“84”消毒液和洁厕灵混合易产生黄绿色有毒气体,写出该反应的离子方程式:。(3)、碘酸钾(KIO3)可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另一种化合物,写出该反应的化学方程式:;该反应中被氧化的Ⅰ原子与被还原的Ⅰ原子的个数之比为 。(4)、二氧化氯泡腾片(有效成分为NaClO2和NaHSO4)也是一种用途广泛的消毒用品,将1片(规格为1g/片)二氧化氯泡腾片溶于1L水中,得到ClO2溶液(假设ClO2全部溶于水且反应后溶液体积仍为1L)。补全生成ClO2的化学方程式:
NaClO2+NaHSO4═ClO2+NaCl+Na2SO4+H2O
-
14、物质类别和核心元素的价态是学习元素化合物性质的重要视角。如图为氯元素的“价—类”二维图,a、b、c、d、e均为含氯元素的物质,下列有关说法错误的是( )
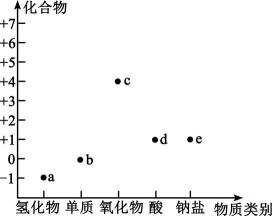 A、a、d均是一元酸且d见光易分解生成a B、干燥的b能使有色鲜花变色 C、c的化学式为Cl2O,可用于自来水杀菌消毒 D、e可作棉麻、纸张的漂白剂和游泳池的消毒剂
A、a、d均是一元酸且d见光易分解生成a B、干燥的b能使有色鲜花变色 C、c的化学式为Cl2O,可用于自来水杀菌消毒 D、e可作棉麻、纸张的漂白剂和游泳池的消毒剂 -
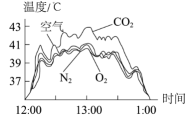
15、如图是利用“手持”技术测定阳光照射不同气体温度变化曲线,其中四个容器均密闭、体积相等且初始压强均为101 kPa,初始温度均为20℃。
下列说法错误的是( )
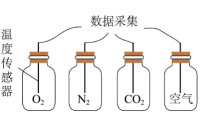 A、若容器的容积为22.4 L,13:00时N2原子个数少于2NA B、实验开始时,四种气体密度相同 C、12:30-13:30时间范围内CO2压强最大 D、CO2是四种气体中温室效应最显著的
A、若容器的容积为22.4 L,13:00时N2原子个数少于2NA B、实验开始时,四种气体密度相同 C、12:30-13:30时间范围内CO2压强最大 D、CO2是四种气体中温室效应最显著的 -
16、下列选项所选用除杂试剂错误的是( )
选项
主要物质
杂质
除杂试剂
A
FeCl3溶液
FeCl2
Cl2
B
NaHCO3溶液
Na2CO3
CO2
C
CO
CO2
NaOH溶液
D
Cl2
HCl
饱和NaHCO3溶液
A、A B、B C、C D、D -
17、硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,不正确的是( )
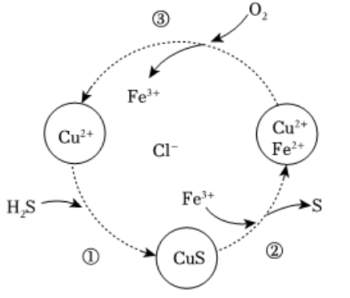 A、过程①中,生成CuS的反应为H2S+Cu2+=CuS↓+2H+ B、过程②中,Fe3+作氧化剂 C、过程③中,各元素化合价均未改变 D、回收S的总反应为2H2S+O2=2H2O+2S↓
A、过程①中,生成CuS的反应为H2S+Cu2+=CuS↓+2H+ B、过程②中,Fe3+作氧化剂 C、过程③中,各元素化合价均未改变 D、回收S的总反应为2H2S+O2=2H2O+2S↓ -
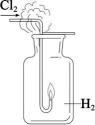
18、下列实验装置正确且能达到对应实验目的的是( )
Ⅰ
 Ⅱ
Ⅱ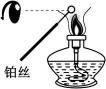 Ⅲ
Ⅲ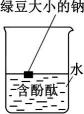 Ⅳ
Ⅳ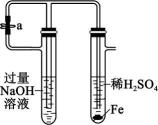 A、图Ⅰ:H2在Cl2中安静地燃烧 B、图Ⅱ:检验待测物中含有钾元素 C、图Ⅲ:观察金属钠与水的反应 D、图Ⅳ:制备并观察Fe(OH)2的颜色
A、图Ⅰ:H2在Cl2中安静地燃烧 B、图Ⅱ:检验待测物中含有钾元素 C、图Ⅲ:观察金属钠与水的反应 D、图Ⅳ:制备并观察Fe(OH)2的颜色 -
19、高铁酸钾(K2FeO4)作净水剂时会产生Fe3+ , 该过程既能消毒杀菌,也能吸附水中悬浮物。制备K2FeO4的一种方法的化学原理可用离子方程式表示为:
3ClO− + 2Fe3+ + 10OH− = 2FeO42− + 3Cl− + 5H2O
下列说法错误的是( )
A、K2FeO4中铁元素的化合价为+6价 B、ClO−作氧化剂,Fe3+被还原 C、0.6 mol ClO−参与反应时生成0.4 mol FeO42− D、K2FeO4净水时会生成Fe(OH)3胶体 -
20、下列物质中均既含有离子键又含有共价键的是( )
①NH4Cl ②H2O2 ③HI ④MgCl2 ⑤NaF ⑥KOH
A、①④ B、③⑤ C、②④ D、①⑥