-
1、一定温度下,将和两种气体混合放入体积为的密闭刚性容器中,发生反应末反应达到平衡,生成 , 并测得的物质的量浓度为 , 下列说法正确的是( )A、此温度下该反应的平衡常数等于0.5 B、的平衡转化率为 C、的值为1 D、和的平衡转化率相等
-
2、下列关于水的电离的说法不正确的是( )A、将水加热至 , 水的电离平衡正向移动, B、向水中加入少量 , 水的电离平衡逆向移动,溶液呈碱性 C、向水中加入少量 , 水的电离平衡正向移动,溶液呈酸性 D、常温下,的盐酸中,水电离的
-
3、某温度下,将和体积均相同的和溶液分别加水稀释,其随加水体积的变化如图所示.下列叙述不正确的是( )
 A、稀释前溶液的浓度: B、溶液中水的电离程度:点<c点 C、从点到点,溶液中逐渐增大 D、在点和点均存在:(酸根阴离子)
A、稀释前溶液的浓度: B、溶液中水的电离程度:点<c点 C、从点到点,溶液中逐渐增大 D、在点和点均存在:(酸根阴离子) -
4、时,的电离常数的电离常数 .
下列说法不正确的是( )
A、溶液和溶液中离子种类相同 B、时,反应的 C、 , 物质的量浓度相同的溶液与溶液的:前者小于后者 D、向氯水中加入少量固体,增大 -
5、已知: , 其他条件相同时,分别测得的平衡转化率在不同压强下随温度变化的曲线(如图),下列说法不正确的是( )
 A、 B、该反应的 C、两点的平衡常数: D、其它条件不变,通入一定量的NO,可使A点到B点
A、 B、该反应的 C、两点的平衡常数: D、其它条件不变,通入一定量的NO,可使A点到B点 -
6、下列事实不能用平衡移动原理解释的是( )A、开启啤酒瓶后,瓶中马上泛起大量泡沫 B、由组成的平衡体系压缩体积后颜色变深 C、实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出 D、实验室用排饱和食盐水法收集
-
7、下列实验装置(部分夹持装置已略去)可以达到对应实验目的是( )
 A、实验1测定锌与稀硫酸的反应速率 B、实验2研究浓度对化学反应速率的影响 C、实验3比较和溶解度大小 D、实验4滴定法测溶液浓度
A、实验1测定锌与稀硫酸的反应速率 B、实验2研究浓度对化学反应速率的影响 C、实验3比较和溶解度大小 D、实验4滴定法测溶液浓度 -
8、 , 已知醋酸的电离常数为 , 将溶液滴入溶液的过程中,溶液中由水电离出的与加入溶液体积的关系如图所示.下列说法正确的是( )
 A、两点溶液的相同 B、b点溶液中离子浓度大小顺序是: C、e点所示溶液中, D、滴定过程中,与的比值逐渐减小
A、两点溶液的相同 B、b点溶液中离子浓度大小顺序是: C、e点所示溶液中, D、滴定过程中,与的比值逐渐减小 -
9、当固体在水中溶解达到平衡时: , 为使固体的量减少,可加入的物质是( )A、 B、 C、 D、
-
10、关于下列各装置图的叙述正确的是( )
 A、用图①装置实现铁上镀铜,极为铁,电解质溶液可以是溶液 B、图②装置盐桥中的移向左侧烧杯 C、图③装置中钢闸门应与外接电源的负极相连获得保护,该方法为牺牲阳极的阴极保护法 D、图④两个装置中通过导线的电子数相同时,正极析出产品的物质的量不同
A、用图①装置实现铁上镀铜,极为铁,电解质溶液可以是溶液 B、图②装置盐桥中的移向左侧烧杯 C、图③装置中钢闸门应与外接电源的负极相连获得保护,该方法为牺牲阳极的阴极保护法 D、图④两个装置中通过导线的电子数相同时,正极析出产品的物质的量不同 -
11、常温下,下列在指定溶液中的各组离子,一定能够大量共存的是( )A、使甲基橙变红的溶液中: B、的溶液中: C、的溶液中: D、水电离的的溶液中:
-
12、下列方程式与所给事实不相符的是( )A、向浊液中滴加溶液,白色浑浊变为黑色: B、用白醋去除水垢的离子方程式: C、向溶液中滴加少量 , 溶液橙色加深: D、氯化铵的水溶液显酸性:
-
13、在一定条件下,溶液中存在平衡,下列说法不正确的是( )A、稀释溶液,增大 B、通入 , 溶液减小 C、升高温度,平衡常数增大 D、加入固体,减小
-
14、下列说法正确的是( )A、 , 则的燃烧热 B、已知: , 则 C、密闭容器中充入和足量发生反应:条件下测得放出的热量 D、 , 常温常压时,锡以灰锡状态存在
-
15、某温度下,体积可变的密闭容器中进行如下反应: , 下列叙述正确的是( )A、在容器中加入氧气,反应物反应速率减小 B、加入少量 , 逆反应速率增大 C、升高温度,正反应速率增大,逆反应速率减小 D、将容器的体积压缩,可增大活化分子的百分数,单位时间内有效碰撞次数增多
-
16、设为阿伏加德罗常数的值,下列说法正确的是( )A、常温下的溶液中数目为 B、常温下,的溶液中氮原子数为 C、碳酸钠溶液含有的数目一定小于 D、粗铜精炼中阳极质量减小时,转移电子数目为
-
17、世界瞩目的港珠澳大桥是世界上最长的斜拉桥,桥受力部件采用高强度拉力钢索.钢索表面的合金保护层含有锌、铝和少量钒,下列说法错误的是( )A、锌位于元素周期表的区 B、基态原子电子占据最高能级的电子云轮廓图为哑铃形 C、钒位于元素周期表中第四周期VB族 D、钥的价层电子排布式为
-
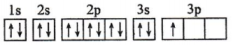
18、由H、C、O、N、S、Al、Fe、Ti等元素能形成多种物质。这些物质有许多用途。请回答下列问题:(1)、某同学写出了铝原子的4种不同状态的电子排布图:A、
 B、
B、 C、
C、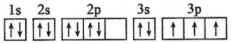 D、
D、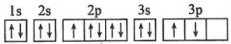
其中能量最低的是______(填字母)。
(2)、C、O、N原子的第一电离能由大到小的顺序为;的键角比的键角(填“大”或“小”)
(3)、铁能与三氮唑(结构见图甲)形成多种配合物。图甲
 图乙
图乙
①1mol三氮唑中所含键的数目为mol;碳原子杂化方式是;
②三氮唑的沸点为 , 与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为 , 前者沸点较高的原因是。
(4)、近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:钙钛矿的化学式为 , 该晶胞中与的最短距离是cm(已知晶胞参数为)。
-
19、是形成雾霾天气的主要原因之一,以为主的污染综合治理是当前重要的研究课题。(1)、通常可采用氢气进行催化还原,消除NO造成的污染。
已知:①;
②;
③。
则催化还原反应。
(2)、可用电解法将硝酸工业的尾气NO转变为 , 其工作原理如图:M极接电源的极,N极的电极反应式为。
 (3)、汽车尾气中含有、以NO为主,净化的主要原理为: , 在时,向恒容密闭体系中通入5mol的NO和5mol的CO进行反应时,体系中压强与时间的关系如图所示:
(3)、汽车尾气中含有、以NO为主,净化的主要原理为: , 在时,向恒容密闭体系中通入5mol的NO和5mol的CO进行反应时,体系中压强与时间的关系如图所示: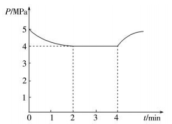
①下列描述能说明反应达到平衡状态的是
A.
B.体系中混合气体密度不变
C.体系中NO、CO的浓度相等
D.混合气体的平均相对分子质量不变
E.单位时间内消耗nmol的NO同时消耗nmol的
②2min时NO的转化率为。
③时的平衡常数(为以平衡分压表示的平衡常数,平衡分压=总压物质的量分数)。若在4min改变的条件为升高温度,减小,则a0(填“大于”“小于”或“等于”)。
-
20、高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图。回答下列问题:

相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子
开始沉淀的pH
8.1
6.3
1.5
3.4
8.9
6.2
6.9
沉淀完全的pH
10.1
8.3
2.8
4.7
10.9
8.2
8.9
(1)、为了加快溶浸效果,可采取的措施有(任写一条);写出“溶浸”中二氧化锰与硫化锰反应的化学方程式。(2)、“氧化”中添加适量的的作用是将氧化为 , 写出该反应的离子方程式。(3)、滤渣2除了含有还含有。(4)、“除杂1”的目的是除去和 , “滤渣3”的主要成分是。(5)、写出“沉锰”的离子方程。(6)、层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 , 其中Ni、Co、Mn的化合价分别为+2、+3、+4。当时,。