-
1、下列解释事实的离子方程式正确的是( )A、泡沫灭火器的反应原理:2Al3++3CO+3H2O=2Al(OH)3↓+3CO2↑ B、向硫酸氢钠溶液中滴加氢氧化钡溶液至溶液呈中性:Ba2++OH-+H++SO=BaSO4↓+H2O C、向AgCl沉淀中滴加NaI溶液,白色沉淀变黄:AgCl(s)+I-(aq) ⇌ AgI(s)+Cl-(aq) D、NaHSO3溶液的水解方程式:HSO+H2O ⇌ H3O++SO
-
2、常温下,下列各组离子在指定溶液中能大量共存的是( )A、溶液中:、、、 B、滴加KSCN溶液后显红色的溶液中:、、、 C、的溶液中:、、、 D、使酚酞变红的溶液中:、、、
-
3、电化学装置能够实现化学能与电能的相互转化。利用下列装置(电极均为惰性电极),实现电解饱和食盐水,下列说法正确的是( )
 A、导线中电子的流动方向:M→Q,N→P B、N电极的电极反应: C、气体a能使湿润的淀粉碘化钾试纸变蓝 D、溶液A为饱和食盐水,溶液C为稀食盐水
A、导线中电子的流动方向:M→Q,N→P B、N电极的电极反应: C、气体a能使湿润的淀粉碘化钾试纸变蓝 D、溶液A为饱和食盐水,溶液C为稀食盐水 -
4、下列关于金属的腐蚀与防护说法正确的是( )
 A、图①中往Fe电极区滴入2滴硫氰化钾溶液,溶液变红 B、图②中铁丝容易生成Fe2O3·xH2O C、图③中M可用石墨代替 D、图④中若电源断开,闸门易发生吸氧腐蚀
A、图①中往Fe电极区滴入2滴硫氰化钾溶液,溶液变红 B、图②中铁丝容易生成Fe2O3·xH2O C、图③中M可用石墨代替 D、图④中若电源断开,闸门易发生吸氧腐蚀 -
5、T ℃ 时,A气体与B气体反应生成C气体。反应过程中A、B、C的浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
 A、t1 min后,其他条件不变,增大压强,平衡向逆反应方向移动 B、t1 min后,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动 C、T ℃ 时,在相同容器中,若通入0.3 mol·L-1 A、0.1 mol·L-1 B和0.4 mol·L-1 C进行反应,达到平衡后,C的浓度仍为0.4 mol·L-1 D、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
A、t1 min后,其他条件不变,增大压强,平衡向逆反应方向移动 B、t1 min后,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动 C、T ℃ 时,在相同容器中,若通入0.3 mol·L-1 A、0.1 mol·L-1 B和0.4 mol·L-1 C进行反应,达到平衡后,C的浓度仍为0.4 mol·L-1 D、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 -
6、下列性质中,可以证明HA是弱酸的是( )
①体积相同、浓度相同的HA溶液与NaOH溶液恰好完全反应;②NaA溶液显碱性;③在相同条件下,物质的量浓度相同的HA溶液的导电性比盐酸弱;④1 mol·L-1的HA溶液的pH=1;⑤HA溶液中HA、A-、H+同时存在;⑥pH相同、体积相同的HA溶液和HCl溶液与Fe反应时,开始放出H2的速率一样
A、①②③⑥ B、②③④⑤ C、①④⑤⑥ D、③⑤⑥ -
7、由多元素组成的化合物Fe-Sm-As-F-O,是我国科学家近年来发现的一种重要的铁系超导材料。下列说法正确的是( )A、O的价层电子排布式为1s22s22p4 B、Fe3+的价层电子轨道表示式
 违背了泡利不相容原理
C、N、As同主族,第一电离能N<As
D、电负性F>O>As
违背了泡利不相容原理
C、N、As同主族,第一电离能N<As
D、电负性F>O>As
-
8、是阿伏加德罗常数的值。下列说法正确的是( )A、120g和的固体混合物中含有的阳离子数为 B、1LNaCl溶液含有个电子 C、常温下,的溶液中,水电离出的数为 D、1L的溶液中,阴离子数等于
-
9、下列事实不能用勒夏特列原理解释的是( )A、实验室中常用排饱和食盐水的方式收集氯气 B、红棕色的气体,加压后颜色先变深后变浅 C、合成氨工业中使用铁触媒作催化剂 D、对熟石灰的悬浊液加热,悬浊液中固体质量增加
-
10、下列说法中,正确的是( )A、冰在室温下自动熔化成水,这是熵增的过程 B、能够自发进行的反应一定是放热反应 C、ΔH<0的反应均是自发进行的反应 D、能够自发进行的反应一定是熵增的过程
-
11、化学与生活,工业生产息息相关。下列有关说法错误的是( )A、明矾和漂白粉常用于自来水的处理,但二者作用的原理不同 B、用硫酸清洗锅炉中的水垢(主要成分是碳酸钙) C、工业上常用作沉淀剂除去废水中的和 D、实验室盛放溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
-
12、是一种高效、安全的消毒剂。实验室制备的原理是用亚氯酸钠固体与纯净、干燥的氯气反应:。如图1是实验室用于制备和收集一定量纯净的的装置(部分夹持装置已省略)。
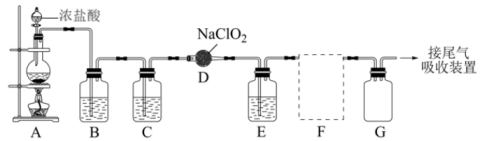 (1)、A中装有浓盐酸的仪器名称为。(2)、圆底烧瓶中发生反应的化学方程式为 , 在该反应中浓盐酸表现的性质是(填序号)。
(1)、A中装有浓盐酸的仪器名称为。(2)、圆底烧瓶中发生反应的化学方程式为 , 在该反应中浓盐酸表现的性质是(填序号)。a.只有还原性 b.还原性和酸性 c.只有氧化性 d.氧化性和酸性
(3)、实验中相关气体在不同溶剂中的溶解性如表所示。HCl
水
极易溶
可溶
极易溶
难溶
易溶
难溶
E装置中的试剂是(填化学式)。
(4)、如图2是一些常用的气体收集装置,F处应选用的收集装置是(填序号),其中与E装置导管相连的导管口是(填接口字母)。
图2
(5)、泡腾片由、固体酸及辅助剂混合制得,是一种家用消毒用品。使用时只需将泡腾片放入水中,5~10分钟即可完全溶解并释放出。泡腾片在使用时需要加水,请补全泡腾片在水中发生反应的离子方程式:
□。
(6)、与比较,消毒效率是的倍(产物均视为 , 消毒效率以单位质量得到的电子数表示,结果精确到0.01)。 -
13、高铝粉煤灰是火力发电厂燃煤锅炉排放出的固体废物,含有较多的和 , 少量的MgO、铁的氧化物及其他不溶性杂质。从粉煤灰中提取的工艺流程如图:
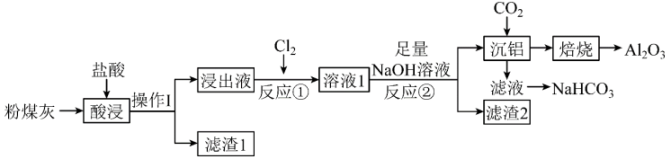
已知:不溶于水,也不溶于稀盐酸
(1)、操作Ⅰ所用的玻璃仪器有:烧杯、、。(2)、滤渣1中除了其他不溶性杂质外,还有(填化学式)。(3)、反应①的离子方程式为 , 检验生成物中阳离子的操作及现象是:。(4)、“沉铝”中反应的化学方程式为。(5)、沉铝后的滤液需要(选填“减压”、“常压”或“加压”)蒸发才能得到固体;(6)、下列实验方案中,不能测定和混合物中质量分数的是____。A、取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 B、取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 C、取a克混合物充分加热,减重b克 D、取a克混合物与足量溶液充分反应,过滤、洗涤、烘干,得b克固体 -
14、请回答下列问题:(1)、在潜水艇和消防员的呼吸面具中,与发生反应的化学方程式为。(2)、利用作为“腐蚀液”和覆铜板反应,制作印刷电路板的反应的离子方程式为。(3)、“84消毒液”是生活中常用的消毒剂。某化学小组配制了500mL“84消毒液”,并在试剂瓶贴上如图所示标签。
“84消毒液”
有效成分:NaClO
规格:500mL
质量分数:14.9%
密度:
①该“84消毒液”有效成分的物质的量浓度为。
②下列说法正确的有。
A.配制过程只需要四种仪器即可完成
B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C.所配得的NaClO消毒液在空气中光照,久置后溶液中的NaClO的物质的量浓度减小
D.上下颠倒摇匀后发现溶液凹液面低于刻度线,应再加水至刻度线
E.定容时,若加水超过刻度线,应重新配制溶液
F.定容时,若俯视刻度线,会使所配制溶液浓度偏低
(4)、曾有报道,在卫生清洁时,混合使用“84消毒液”与“洁厕灵”(主要成分是盐酸)而发生氯气中毒事件,请用离子方程式解释原因:。(5)、某溶液可能含有、、、、、、、中的几种离子,已知各离子的物质的量浓度均相等,进行如下实验:Ⅰ.取少量该溶液,加入足量稀硫酸,无明显现象。
Ⅱ.取实验Ⅰ反应后的溶液,加入足量浓NaOH溶液,最终得到红褐色沉淀,并伴有刺激性气味气体产生。(已知:)
①该溶液中肯定存在的离子有。
②若取原溶液进行焰色试验,焰色显黄色,则溶液中一定存在的离子有种。
-
15、下表是元素周期表的一部分,请参照元素①~⑤在表中的位置,回答下列问题:
族
周期
ⅠA
0
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
②
③
④
3
⑤
⑥
⑦
⑧
(1)、⑧的最高价氧化物的水化物的化学式是。(2)、④、⑤、⑥、⑦四种元素的离子半径由大到小排序(写离子符号)。(3)、元素③、④形成的简单气态氢化物的稳定性中较大的是(填化学式)。(4)、⑤和⑦的最高价氧化物的水化物之间发生反应的离子方程式为。(5)、下列事实能判断⑤和⑥的金属性强弱的是(填字母,下同)。a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
(6)、硒(Se)位于第四周期,与④同主族。下列推断正确的是。a.只具有还原性
b.Se的最低负化合价是-2价
c.Se的最高价氧化物对应水化物的酸性比强
(7)、同温同压下,0.2mol的⑤、⑥、⑦单质分别与100mL1mol/L的盐酸充分反应,产生氢气的体积比为。 -
16、下列选项描述与对应图像相符的是( )
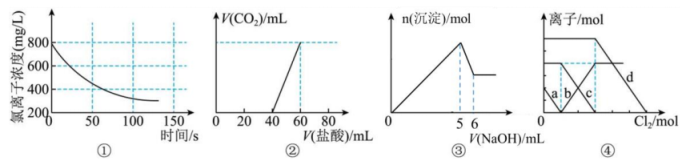 A、图①为新制氯水在阳光直射时,溶液中浓度随着时间变化的曲线 B、图②为、混合液中滴加盐酸产生的图像 C、图③为和混合溶液中滴加NaOH溶液生成沉淀的图像,由图可知原混合液中 D、图④为、混合液,各离子物质的量随氯气通入的变化图像,b代表的是
A、图①为新制氯水在阳光直射时,溶液中浓度随着时间变化的曲线 B、图②为、混合液中滴加盐酸产生的图像 C、图③为和混合溶液中滴加NaOH溶液生成沉淀的图像,由图可知原混合液中 D、图④为、混合液,各离子物质的量随氯气通入的变化图像,b代表的是 -
17、某兴趣小组为测定某含铁氧化物中铁元素的百分含量,其操作流程如下:

下列说法正确的是( )
A、操作Ⅰ、操作Ⅲ均为过滤 B、操作Ⅱ若未使用 , 则固体d的质量小于32g C、灼烧需要的仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳等 D、该含铁氧化物中 -
18、下列有关元素周期表的说法中错误的是( )A、第ⅢB族到第ⅡB族10个纵行的元素都是金属元素 B、0族元素原子最外层电子数均满足8电子稳定结构 C、117号元素在周期表中的位置为:第七周期第ⅦA族 D、在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料
-
19、关于卤素(用X表示)的下列叙述正确的是( )A、卤素单质的颜色从 , 随着相对分子质量的增大而加深 B、HX都极易溶于水,它们的酸性随核电荷数增加而减弱 C、卤素单质与水反应均可用表示 D、X的还原性依次为 , 最高价含氧酸的酸性为
-
20、《化学》第一册“方法导引”栏目呈现了4种学习方法,有关说法错误的是( )
选项
方法导引
内容或例子
A
认识元素及其化合物性质的视角
从物质类别视角分析 , 是金属氧化物,可能与酸发生反应;从化合价视角分析 , 铁元素为+2、+3价,既具有氧化性,也具有还原性
B
模型
阿伦尼乌斯提出的电离模型很好的解释了酸、碱、盐溶液的某些性质
C
实验室制取气体装置设计
实验室制备的氯气依次通过饱和食盐水和浓硫酸的除杂装置,可以得到干燥纯净的氯气
D
预测
锂和钠均为元素周期表ⅠA族元素,可预测出:在加热条件下,锂单质与氧气反应也可以生成过氧化锂
A、A B、B C、C D、D