-
1、下列实验装置能够达到实验目的的是( )
 A、图a测定醋酸的浓度 B、图b由溶液制取无水 C、探究压强对平衡的影响 D、图d验证保护了
A、图a测定醋酸的浓度 B、图b由溶液制取无水 C、探究压强对平衡的影响 D、图d验证保护了 -
2、近日,清华大学等重点高校为解决中国“芯”——半导体芯片,成立了“芯片学院”.某小组拟在实验室制造硅,其流程如下图.
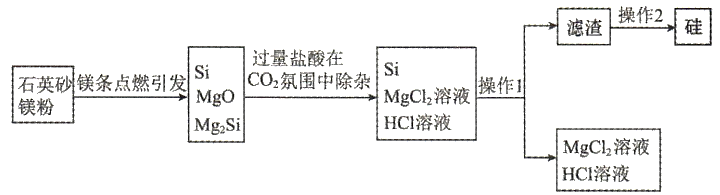
已知:
下列说法中错误的是( )
A、点燃镁条引发反应的过程中,涉及两种晶体类型的变化 B、氛围是为了阻止被二次氧化和自燃 C、操作2为用去离子水洗涤并烘干 D、镁粉生成和的混合物,转移电子 -
3、某立方晶系的锑钾合金可作为钾离子电池的电极材料,下图表示晶胞.下列说法中错误的是( )
 A、该晶胞的体积为 B、和原子数之比为 C、与最邻近的原子数为4 D、该晶胞的俯视图为
A、该晶胞的体积为 B、和原子数之比为 C、与最邻近的原子数为4 D、该晶胞的俯视图为
-
4、下列说法中错误的是( )A、根据水的沸点高于氟化氢,推断分子间氢键数目: B、根据推电子基团种类不同,推断酸性: C、根据核外电子数不同,推断核外电子空间运动状态种类: D、根据中心原子电负性不同,推断键角:
-
5、用NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、4.6 g Na与含0.1 mol HCl的稀盐酸充分反应,转移电子数目为0.1NA B、25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA C、常温下,14克C2H4和C3H6混合气体所含的原子数为3NA D、等质量的1H218O与D216O,所含中子数前者大
-
6、下列除杂试剂或操作不正确的是(括号内的物质为杂质)( )A、NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加盐酸调pH至中性 B、KNO3溶液(AgNO3):加过量盐酸,再加NaOH溶液调pH至中性 C、BaSO4(BaCO3):加足量稀盐酸后过滤、洗涤、干燥 D、NaHCO3溶液(Na2CO3):通入足量CO2气体充分反应
-
7、历史文物或古文学的描述中均蕴含着化学知识,下列说法正确的是( )A、商代的后母戊鼎属于青铜制品,青铜是一种合金 B、“浮梁巧烧瓷”描述的是我国驰名于世的陶瓷,陶瓷的主要成分是二氧化硅 C、“绚丽丝绸云涌动,霓裳歌舞美仙姿”中“丝绸”的主要成分是纤维素 D、敦煌莫高窟壁画中绿色颜料的主要成分是氧化铁
-
8、氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:(1)、根据图1数据计算反应N2(g)+ H2(g)=NH3(g)的ΔH=kJ•mol-1。
 (2)、研究表明,合成氨反应在Fe催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,N表示被吸附于催化剂表面的N2)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为 (填步骤前的标号),理由是 。
(2)、研究表明,合成氨反应在Fe催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,N表示被吸附于催化剂表面的N2)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为 (填步骤前的标号),理由是 。 (3)、在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如图所示。其中一种进料组成为=0.75、=0.25,另一种为=0.675、=0.225、xAr=0.10(物质i的摩尔分数:xi=)。
(3)、在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如图所示。其中一种进料组成为=0.75、=0.25,另一种为=0.675、=0.225、xAr=0.10(物质i的摩尔分数:xi=)。
①图中压强由小到大的顺序为 , 判断的依据是 。
②进料组成中含有惰性气体Ar的图是 。
③图3中,当 p2=20MPa、=0.20时,氮气的转化率α=。该温度时,反应N2(g)+3H2(g)=2NH3(g)的平衡常数Kp=(MPa)-2。
-
9、已知汽车尾气排放时容易发生以下反应:
I.
Ⅱ.
请回答下列问题:
(1)、若CO的燃烧热()为−283.5 kJ/mol,则反应Ⅱ的。(2)、CO和也可发生类似于反应Ⅱ的变化,热化学方程式为 。一定温度下,向2L恒容密闭容器中充入4.0mol 和4.0mol CO,测得相关数据如下表:0min
5 min
10 min
12 min
20 min
4.0
3.4
3.12
3
3
0
0.3
0.44
0.5
0.5
①0~5min内,;该温度下反应的化学平衡常数K=(保留两位有效数字)。
②其他条件不变,升高温度,平衡转化率(填“增大”、“减小”或“不变”)。
③20min时,保持其他条件不变,再向容器中通入0.4mol CO、0.7mol 和0.4mol , 此时(填“>”、“<”或“=”)。
-
10、化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式计算获得。(1)、热量的测定:取50 mL 0.5 mol/L盐酸、50 mL 0.55 mol/L NaOH溶液和如图所示装置进行中和热的测定实验。

①从实验装置上看,图中缺少的一种玻璃仪器是。
②测得反应前后体系的温度值(℃)分别为、 , 则该过程放出的热量为J(c和分别取和)。
③如果改用60 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L NaOH溶液进行反应,则与上述实验相比,所放热量(填“增加”“减少”或“不变”);所求中和热数值(填“增加”“减少”或“不变”)
(2)、借鉴(1)的方法,甲同学测量放热反应焓变(忽略温度对焓变的影响,下同)。实验结果见下表。序号
反应试剂
体系温度/℃
反应前
反应后
i
溶液100mL
1.20g Fe粉
a
b
ii
0.56g Fe粉
a
c
①温度:bc(填“>”“<”或“=”)。
②(选择表中一组数据计算)。结果表明,该方法可行。
(3)、乙同学也借鉴(1)的方法,测量反应A:的焓变。查阅资料:配制溶液时需加入酸。
①提出猜想:Fe粉与溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。
验证猜想:用pH试纸测得溶液的pH不大于1;向少量溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和(用离子方程式表示)。
实验小结:猜想成立,不能直接测反应A的焓变。
教师指导:鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
②优化设计:乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为。
(4)、化学能可转化为热能,写出其在生产或生活中的一种应用。 -
11、能源是现代社会发展的支柱之一、(1)、下列反应中,属于吸热反应的是(填序号)。
a.灼热的炭与二氧化碳反应 b.煅烧石灰石 c.铝与盐酸反应 d.盐酸与碳酸氢钠反应
(2)、已知稀溶液中,1mol 与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示与NaOH反应的中和热的热化学方程式。(3)、实验测得,1g甲醇( , 常温下为液态)在氧气中完全燃烧释放出20kJ的热量,则表示甲醇燃烧热的热化学方程式为:。(4)、恒温恒容时,能表明达平衡状态的是____ (填字母)A、单位时间内生成n mol CO同时消耗n mol B、c(CO) 不随时间改变 C、的体积分数不变 D、Fe的浓度不变 E、容器内压强不再变化 F、正反应的平衡常数不再变化 G、气体的总质量不再变化 -
12、钠和氧气反应生成氧化钠的能量关系如左下图所示。下列说法正确的是( )
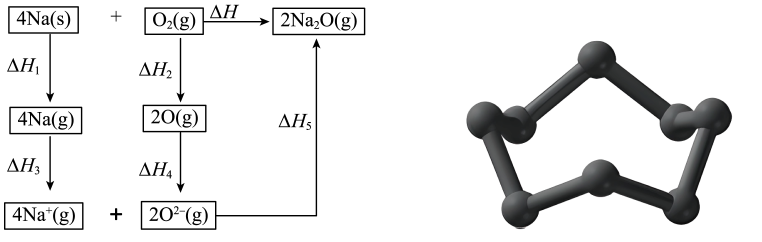 A、 B、 , 则 C、已知的结构如右下图所示, , 则的数值等于S-S键能 D、若 , 则与生成的反应在低温下自发
A、 B、 , 则 C、已知的结构如右下图所示, , 则的数值等于S-S键能 D、若 , 则与生成的反应在低温下自发 -
13、向一恒容密闭容器中加入1mol 和一定量的 , 发生反应:。的平衡转化率按不同投料比[]随温度的变化曲线如图所示,下列说法错误的是( )
 A、 B、反应速率: C、点a、b、c对应的平衡常数: D、反应温度为 , 当容器内压强不变时,反应达到平衡状态
A、 B、反应速率: C、点a、b、c对应的平衡常数: D、反应温度为 , 当容器内压强不变时,反应达到平衡状态 -
14、已知反应A(g) +2B(g)3C(g),ΔH<0,向一恒温恒容的密闭容器中充入1molA(g)和 3molB(g)发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( )
 A、若容器内压强不变,表明反应达到平衡 B、t2时改变的条件:向容器中加入B C、平衡常数K:K(Ⅱ) <K(Ⅰ) D、平衡时A的体积分数φ(Ⅱ)>φ(Ⅰ)
A、若容器内压强不变,表明反应达到平衡 B、t2时改变的条件:向容器中加入B C、平衡常数K:K(Ⅱ) <K(Ⅰ) D、平衡时A的体积分数φ(Ⅱ)>φ(Ⅰ) -
15、如图为和在碘化烷基作用下耦合制备丙烯酸乙酯的机理。下列说法不正确的是( )
 A、是反应的催化剂 B、
A、是反应的催化剂 B、 是反应的中间产物
C、若将换为 , 则有机产物为
是反应的中间产物
C、若将换为 , 则有机产物为 D、该过程总反应方程式为C2H4+CO2+CH3CH2I
D、该过程总反应方程式为C2H4+CO2+CH3CH2I +HI
+HI
-
16、苯乙烷与在光照条件下发生一氯取代,反应历程如图所示。下列说法错误的是( )
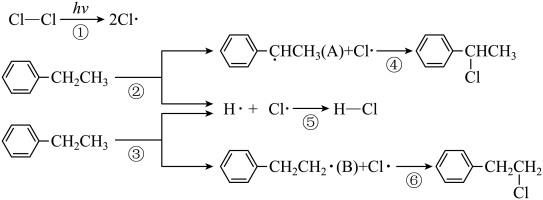 A、反应①②③的 B、使用恰当的催化剂,可以使反应②的程度减小,反应③的程度增大 C、已知物质A的稳定性大于B,则分别获得等物质的量A和B,前者需要的能量更少 D、为加快反应速率,可在日光直射的地方进行实验
A、反应①②③的 B、使用恰当的催化剂,可以使反应②的程度减小,反应③的程度增大 C、已知物质A的稳定性大于B,则分别获得等物质的量A和B,前者需要的能量更少 D、为加快反应速率,可在日光直射的地方进行实验 -
17、一定条件下存在反应: , 。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是( )
 A、容器Ⅰ、Ⅲ中平衡常数相同 B、容器Ⅱ、Ⅲ中正反应速率相同 C、的体积分数:Ⅱ>Ⅲ D、容器Ⅰ和容器Ⅱ中的体积分数相同
A、容器Ⅰ、Ⅲ中平衡常数相同 B、容器Ⅱ、Ⅲ中正反应速率相同 C、的体积分数:Ⅱ>Ⅲ D、容器Ⅰ和容器Ⅱ中的体积分数相同 -
18、金属可活化放出 , 其反应历程如图所示:

下列关于活化历程的说法错误的是( )
A、反应中涉及极性键和非极性键的断裂以及极性键的生成 B、加入催化剂使正反应活化能和逆反应活化能均降低 C、和的总键能大于和的总键能 D、中间体中间体3的过程是决定整个历程反应速率的关键步骤 -
19、利用铜-铈氧化物( , Ce是活泼金属)催化氧化除去中少量CO的可能机理如图所示。下列说法正确的是( )
 A、反应(iii)中Cu、Ce化合价均未改变 B、反应一段时间后催化剂活性下降,可能是CuO被还原成Cu所致 C、若用参与反应,一段时间后,不可能出现在铜-铈氧化物中 D、铜-铈氧化物减小了反应的反应热
A、反应(iii)中Cu、Ce化合价均未改变 B、反应一段时间后催化剂活性下降,可能是CuO被还原成Cu所致 C、若用参与反应,一段时间后,不可能出现在铜-铈氧化物中 D、铜-铈氧化物减小了反应的反应热 -
20、已知I.碳碳双键加氢时总要放出热量,并且放出的热量与碳碳双键的数目大致成正比;II.1,3-环己二烯(
 )脱氢生成苯是放热反应。相同温度和压强下,关于反应的ΔH,下列判断正确的是( )
)脱氢生成苯是放热反应。相同温度和压强下,关于反应的ΔH,下列判断正确的是( )①
 (g)+H2(g)→
(g)+H2(g)→ (g)ΔH1
(g)ΔH1②
 (g)+2H2(g)→
(g)+2H2(g)→ (g)ΔH2
(g)ΔH2③
 (g)+3H2(g)→
(g)+3H2(g)→ (g) ΔH3
(g) ΔH3④
 (g)+H2(g)→
(g)+H2(g)→ (g) ΔH4A、ΔH1>0,ΔH2>0 B、ΔH3=ΔH1+ΔH2 C、ΔH1>ΔH2 , ΔH2﹤ΔH4 D、ΔH2=ΔH3+ΔH4
(g) ΔH4A、ΔH1>0,ΔH2>0 B、ΔH3=ΔH1+ΔH2 C、ΔH1>ΔH2 , ΔH2﹤ΔH4 D、ΔH2=ΔH3+ΔH4