-
1、某兴趣小组为制备氯气并验证其性质,做了如下实验,实验装置如图所示(部分固定装置未画出)。下列说法不正确的是( )
 A、将装置A中换成 , 也能达到实验目的 B、装置B有除去及作安全瓶的作用 C、装置C中有色布条Ⅰ和Ⅱ均褪色 D、为验证非金属性: , 应在装置D中溶液变为橙黄色后马上打开旋塞
A、将装置A中换成 , 也能达到实验目的 B、装置B有除去及作安全瓶的作用 C、装置C中有色布条Ⅰ和Ⅱ均褪色 D、为验证非金属性: , 应在装置D中溶液变为橙黄色后马上打开旋塞 -
2、蟾毒色胺可在人脑组织中生成,有致幻作用,其结构如图所示。关于该化合物,下列说法不正确的是( )
 A、能发生加聚反应 B、其分子式为 C、能与等物质的量的发生加成反应 D、既能与盐酸反应,又能与溶液反应
A、能发生加聚反应 B、其分子式为 C、能与等物质的量的发生加成反应 D、既能与盐酸反应,又能与溶液反应 -
3、化学与我们的生产生活息息相关。下列生产生活实例与对应的化学原理没有关联的是( )
选项
生产生活实例
化学原理
A
苯甲酸钠可用作食品防腐剂
苯甲酸钠可溶于水
B
医用酒精可用于杀菌消毒
酒精能使蛋白质变性
C
炒菜时加入醋和料酒产生特殊香味
醋酸和乙醇反应能生成酯
D
用生石灰改良酸性土壤
能与酸反应
A、A B、B C、C D、D -
4、某医院设计的锌-铁原电池,可以控制胃内氢释放,改善肥胖2型糖尿病的胰岛素抵抗。其工作原理如图所示,下列说法不正确的是( )
 A、代表 B、该过程发生析氢腐蚀 C、表面的电极反应为 D、标准状况下,每生成2.24mL , 理论上原电池质量损耗0.013g
A、代表 B、该过程发生析氢腐蚀 C、表面的电极反应为 D、标准状况下,每生成2.24mL , 理论上原电池质量损耗0.013g -
5、“和而不同”彰显了中华传统文化的智慧。下列说法不正确的是( )A、与互为同位素 B、红磷与白磷互为同素异形体 C、与属于同一主族元素 D、苯甲酸(
 )与对羟基苯甲醛(
)与对羟基苯甲醛(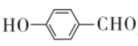 )互为同分异构体
)互为同分异构体
-
6、下列有关氨气的制备、干燥、收集以及尾气处理操作和装置正确的是( )

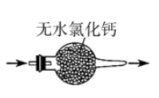


A.制备
B.干燥
C.收集
D.尾气处理
A、A B、B C、C D、D -
7、美丽化学,魅力化学。下列说法正确的是( )A、山水国画所用的墨水属于胶体 B、青花陶瓷中的青色来自四氧化三铁 C、舞台表演“造雾”所用的干冰属于共价晶体 D、节日烟花利用了焰色试验原理,该变化属于化学变化
-
8、科学技术是第一生产力。下列说法不正确的是( )A、5G技术核心部件为芯片,其主要成分是高纯 B、可降解吸管的成分是聚乳酸(
 ),其属于酯类物质
C、“盐湖提锂”是从卤水中提取高纯度的锂单质,该过程涉及氧化还原反应
D、“蛟龙号”潜水器最关键的部件由钛()合金制得,位于元素周期表区
),其属于酯类物质
C、“盐湖提锂”是从卤水中提取高纯度的锂单质,该过程涉及氧化还原反应
D、“蛟龙号”潜水器最关键的部件由钛()合金制得,位于元素周期表区
-
9、中华文化源远流长。下列物品的主要成分为硅酸盐的是( )




A.广粤刺绣
B.宜兴紫砂壶
C.卯榫结构屋檐
D.青铜神树
A、A B、B C、C D、D -
10、冬季是中老年人易发脑血管疾病的季节,化合物H可用于治疗脑血管疾病,其合成路线如下:

回答下列问题:
(1)、B的化学名称是 , c中含氧官能团的名称是。(2)、根据化合物H的结构特征,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
a
还原反应
b
酯化反应
(3)、反应④的原子利用率为100%,则E的结构简式是。(4)、关于反应⑥的说法中,不正确的有____A、该反应的反应类型属于氧化反应 B、反应过程中,有N-H单键形成 C、反应物G中,氧原子均采取sp3杂化,并且存在手性碳原子 D、生成物H溶于水是因为羧基和氨基与水分子之间存在氢键(5)、芳香化合物X是H的同分异构体,化合物X含有-NO2 , 其核磁共振氢谱峰面积比为3:2:1,写出两种符合要求的化合物X的结构简式。(6)、以 和
和 为含碳原料,利用题干信息,合成化合物
为含碳原料,利用题干信息,合成化合物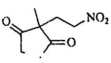 , 基于你设计的合成路线,回答下列问题:
, 基于你设计的合成路线,回答下列问题:(a)最后一步反应中,有机反应物为(写结构简式)。
(b)相关步骤涉及到
 消去反应,其化学方程式为。
消去反应,其化学方程式为。 -
11、甲醇是种可再生能源,甲醇水蒸气催化重整是当前制取清洁能源氢*(的主要方法,其反应机理如下:
主反应反应Ⅰ:CH3OH(g)+H2O(g)CO2(g)+3H2(g) △H1>0
副反应反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)△H2
(1)、CO2的空间构型为。相关键能如下表,则△H2=。化学键
H-H
C≡O
O-H
C=O
键能/(kJ/mol)
a
b
c
d
(2)、在绝热恒容的密闭容器中,将CH3OH和H2O按照物质的量比1:1投料,如果只发生反应Ⅰ,下列说法正确的是____(填编号)。A、体系的温度保持不变,说明反应Ⅰ经达到平衡 B、CH3OH和H2O的转化率始终保持相等 C、加入稀有气体后H2的物质的最增加 D、反应过程中温度升高,反应的v正增大,v逆减小(3)、1mol甲醇气体和1.2mol水蒸气混合充入1L恒温恒容密闭容器中,起始压强为2.2MPa下进行反应,平衡时容器中n(CH3OH)=n(CO)=0.1mol,此时H2O的浓度为 , 则甲醇水蒸气重整的反应平衡常数Kp=(用平衡分压代替平衡浓度,分压=总压×物质的量分数,结果保留一位小数)。(4)、研究表明,甲醇水蒸气重整反应速率表达式为v=kp0.26(CH3OH)p0.03(H2O)p-0.2(H2),k随温度升高而增大。反应体系中水醇比影响催化剂活性,进而影响甲醇转化率和产氢速率,如图所示。提高重整反应速率的合理措施除升高温度外,还可以(至少答两种措施) (5)、作为再生能源,甲醇可做燃料电池的燃料,如图是以NaOH溶液为电解质溶液的甲醇燃料电池,电极b的电极反应式为。当消耗1mol甲醇时,溶液中有molNa+向正极区移动。
(5)、作为再生能源,甲醇可做燃料电池的燃料,如图是以NaOH溶液为电解质溶液的甲醇燃料电池,电极b的电极反应式为。当消耗1mol甲醇时,溶液中有molNa+向正极区移动。
-
12、开发新型材料是现在科学研究的一项重要工作,科学家开发一种形状记忆陶瓷,它的主要原材料是纳米级ZrO2。用锆石ZrSiO4(含少量FeO、Al2O3、SiO2和CuO)制备纳米级ZrO2的流程设计如图:

回答下列问题:
(1)、锆石杂质中含锆元素,基态Cu的价电子排布式为 , 锆石杂质中含铁元素,已知Fe2+易被氧化为Fe3+ , 原因是。(从原子结构角度解释)(2)、碱熔过程中有多种物质能发生反应,写出其中一个反应方程式。(3)、“酸浸”过程中FeO发生氧化还原反应的离子方程式为 , 滤渣Ⅰ经回收加工后有多种用途,写出其中一种。(4)、久置H2O2浓度需要标定。取xmLH2O2溶液,用amol/LCe(SO4)2溶波滴定H2O2 , 完全反应转化为Ce2(SO4)3时,消耗bmLCe(SO4)2溶液。则H2O2溶液的浓度为:mol/L。(5)、易溶氰化物有剧毒,需对滤液Ⅰ中的氰化物进行处理,选用次氯酸钠溶液在碱性条件下将其氧化,其中一种产物为空气的主要成分,写出其离子反应方程式。(6)、ZrO2的晶胞结构如图所示。
①其中B表示(填O2-或Zr4+)。
②ZrO2晶胞的棱长分别为anm、anm、cnm,其晶体密度为g/cm3(列算式用NA表示阿伏加德罗常数的值)。
-
13、工业上通过电解饱和食盐水的方法制备氢气、氢气和烧碱.请回答下列问题:(1)、工业食盐水中含CaCl2、MgCl2、Na2SO4杂质,需精制获取精盐,精制过程中依次加入的四种试剂为氢氧化钠溶液、、稀盐酸。(2)、不同于工业上电解饱和食盐水制取氯气,实验室通过浓盐酸和二氧化锰制备氯气。实验室模拟通过下列装置制备氯化铝。已知氯化铝不宜与水接触,178℃升华。

①实验开始前,装置A中盛放浓盐酸的仪器名称是。写出A装置中发生反应的离子方程式。
②在答题卡上将F装置补充完整,并标注相应试剂名称。
(3)、某兴趣小组用电解得到的氢氧化钠对乙酸乙酯碱性条件下水解反应反应速率进行了探究。CH3COOC2H5+NaOH→CH3COONa+C2H5OH
实验试剂:0.010mol/LNaOH溶液、0.010mol/L乙酸乙酯、蒸馏水
方案1:查阅资料可知水解溶液电导率随c(OH-)降低而减小,温度对该反应电导率影响可以忽略不计。通过测定不同时刻的电导率,来探究乙酸乙酯水解速率的影响因素,设计如下实验。
实验步骤:向试管中加入10mL0.010mol/LNaOH溶液,再加入10mL0.010mol/L乙酸乙酯,再把试管放入置于30℃恒温槽中,每隔10min用电导率仪测定电导率,重复3次,电导率取平均值,改变温度至35℃,重复实验3次,电导率取平均值。
数据记录:乙酸乙酯水解后电导率(单位为mS/cm)
组别
温度
时间/min
0
10
20
30
40
50
1
30
1417
1173
1056
976
907
869
2
35
A1
A2
A3
A4
A5
A6
①分析第1组实验中数据,随着反应进行,反应速率(增大、减小、不变),从速率影响因素角度分析其原因是。
②从上述实验中能得出温度升高,反应速率增大判断依据是(用字母和数字表示)。
方案2:利用乙醇测定仪直接测定反应相同时间(t)后溶液中乙醇的浓度来探究乙酸乙酯碱性环境水解速率的影响因素(NaOH溶液浓度、反应温度),设计如下实验。
③参照下表格式,在已有基础上拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
实验序号 0.010mol/L乙酸乙酯溶液体积/mL ________ ________ ________ 反应相同时间后乙醇浓度/mol/L 1 10 ________ ________ ________ c1 2 10 ________ ________ ________ c2 3 10 ________ ________ ________ c3 -
14、研究NOx之间的转化对大气污染控制具有重要意义,已知:N2O4(g)2NO2(g) △H>0,如图所示,在恒容密闭容器中,反应温度为T1时,c(N2O4)和c(NO2)随t变化为曲线Ⅰ、Ⅱ,改变温度到T2 , c(NO2)随t变化为曲线Ⅲ。下列判断正确的是( )
 A、温度T1>T2 B、反应速率v(a)<v(b) C、K(T1)>K(T2) D、在T2温度下,反应在0-t1内的平均速率为v(N2O4)=mol/(L·s)
A、温度T1>T2 B、反应速率v(a)<v(b) C、K(T1)>K(T2) D、在T2温度下,反应在0-t1内的平均速率为v(N2O4)=mol/(L·s) -
15、水系钠离子电池有成本低、寿命长、环保等诸多优势,未来有望代替锂离子电池和铅酸电池。一种水系钠离子电池放电和充电的工作原理示意图如图所示。下列说法错误的是( )
 A、放电时,光可以促进电子转移 B、放电时,工作一段时间,M电极区Na+浓度减小 C、充电时,M极发生还原反应 D、充电时,阳极的电极反应式为3I--2e-=
A、放电时,光可以促进电子转移 B、放电时,工作一段时间,M电极区Na+浓度减小 C、充电时,M极发生还原反应 D、充电时,阳极的电极反应式为3I--2e-= -
16、化学是辩证的科学,化学原理和实际应用具有逻辑关联。下列陈述Ⅰ和陈述Ⅱ均正确,且具有因果关系的是:( )
选项
陈述Ⅰ
陈述Ⅱ
A
SiO2为共价晶体,Si-O键能大
SiO2熔沸点高,不能与强碱反应
B
Na2FeO4具有强氧化性且Fe3+可水解产生胶体
Na2FeO4可做消毒剂和净水剂
C
N的电负性较大
N2较稳定,常温下不易发生反应
D
硅酸钠溶液水解呈酸性,形成硅酸沉淀
硅酸钠溶液可用于木材防腐
A、A B、B C、C D、D -
17、根据下列实验操作和现象,所得实验结论正确的是( )
选项
实验操作和现象
实验结论
A
向1mL1mol/LNaCl溶液中滴加2滴1mol/LAgNO3溶液,生成白色沉淀;再滴加2滴1mol/LKI溶液,白色沉淀变成黄色沉淀
Ksp(AgI)<Ksp(AgCl)
B
室温下,将BaSO4投入饱和Na2CO3溶液中充分反应,向过滤后所得固体中加入足量盐酸,固体部分溶解有无色无味气体产生
Ksp(BaSO4)>Ksp(BaCO3)
C
常温下,测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH,前者的pH大
非金属性:S>C
D
乙酸乙酯的制备实验中,将产生的蒸气经导管通入到饱和NaOH溶液中,振荡,溶液未见分层
实验中未制备乙酸乙酯
A、A B、B C、C D、D -
18、甲胺(CH3NH2)是以种弱碱,可与盐酸反应生成盐酸盐(用CH3NH3Cl表示)。下列叙述正确的是( )A、CH3NH3Cl在水中的电离方程式为:CH3NH3Cl+Cl- B、0.01mol/LCH3NH2水溶液的pH=12 C、0.1mol/LCH3NH2水溶液加水稀释,pH降低 D、CH3NH3Cl水溶液中:c(Cl-)>c(H+)>( CH3NH)>(OH-)
-
19、短周期主族元素W、X、Y、Q的原子序数依次增大。W、X原子的最外层电子数之和为6,且符合核反应:+→+;Y和Q一样,其原子中s电子与p电子数目相同。下列说法正确的是( )A、Q的最高价氧化物对应水化物易溶于水且完全电离 B、X与Y只能形成原了个数比为1:1的化合物 C、原子半径:W>Y>Q D、X的最高价氧化物与单质Q可以发生反应
-
20、H2O2在纸张漂白和废水处理等领域有重要应用。一定条件下用H2和O2合成H2O2的反应过程如图所示。设NA为阿伏加德罗常数的值,下列说法正确的是( )
 A、1molH2O2中含2NAσ键,不含π键 B、合成1molH2O2 , 电子转移数为4NA C、1mol的H2O2含18NA电子 D、标准状况下,4.48LH2O2中含有0.2NAH2O2分子
A、1molH2O2中含2NAσ键,不含π键 B、合成1molH2O2 , 电子转移数为4NA C、1mol的H2O2含18NA电子 D、标准状况下,4.48LH2O2中含有0.2NAH2O2分子