-
1、在一定温度下的可逆反应 , , , 若该温度下的平衡常数K=10,下列说法错误的是( )A、该温度下 B、升高温度,增大的倍数大于增大的倍数 C、有利于测定X的相对分子质量的条件为低温高压 D、恒压条件下,向平衡体系中充入惰性气体He,X的转化率减小
-
2、下列有关下图所示装置或图象的判断或说法错误的是( )
 A、图甲所示反应为2A(g)+B(g)=2C(g) ΔH>0 B、根据图乙可判断:石墨转变为金刚石是吸热反应 C、结合盖斯定律,由图丙可得:ΔH1=ΔH2+ΔH3 D、图丁所示实验发生的为放热反应
A、图甲所示反应为2A(g)+B(g)=2C(g) ΔH>0 B、根据图乙可判断:石墨转变为金刚石是吸热反应 C、结合盖斯定律,由图丙可得:ΔH1=ΔH2+ΔH3 D、图丁所示实验发生的为放热反应 -
3、P4S3可用于制造安全火柴,相关物质的结构及键能如表所示。

共价键
S—S
P—P
P—S
键能(kJ·mol-1)
a
b
c
则反应S8(s)+P4(s)=P4S3(s)的△H为( )
A、(a+b-c)kJ·mol-1 B、(c-a-b)kJ·mol-1 C、(3a+3b-6c)kJ·mol-1 D、3(2c-b-a)kJ·mol-1 -
4、反应物(X)转化为产物(Y)时的能量变化与反应进程的关系如图曲线①所示,在反应中仅改变一种外界条件,可得到如图曲线②。下列说法正确的是( )
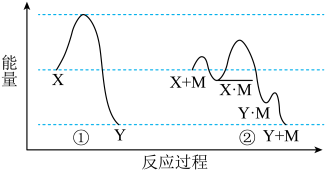 A、该反应是吸热反应 B、为反应所加的催化剂 C、改变该条件后,降低了反应的焓变 D、该条件的改变增大了单位体积内活化分子百分数
A、该反应是吸热反应 B、为反应所加的催化剂 C、改变该条件后,降低了反应的焓变 D、该条件的改变增大了单位体积内活化分子百分数 -
5、在密闭容器中投入足量CaC2O4 , 在T℃发生反应:CaC2O4(s)CaO(s)+CO2(g)+ CO(g),达到平衡测时得c(CO)=a mol·L-1。保持温度不变,压缩体积至原来的一半,达到新平衡时测得c(CO2)为( )A、0.5a mol·L-1 B、a mol·L-1 C、1.5a mol·L-1 D、2a mol·L-1
-
6、下列事实能用勒夏特列原理解释的是( )A、打开可乐瓶盖,有大量气泡产生 B、已知工业合成氨是放热反应,反应条件选择高温 C、SO2催化氧化时,使用催化剂加快化学反应速率 D、 , 平衡后压缩容器,体系颜色加深
-
7、下列说法正确的是( )A、在常温下能自发进行,则该反应的 B、反应在室温下可自发进行,则该反应的 C、室温下不能自发进行,说明该反应的 D、常温下,反应不能自发进行,则该反应的
-
8、采取下列措施对增大化学反应速率有明显效果的是( )A、Na与水反应时,增加水的用量 B、Al与稀硫酸反应制取氢气时,改用浓硫酸 C、Na2SO4溶液与BaCl2溶液反应时,增大压强 D、Zn与稀硫酸反应时滴入少量CuSO4溶液
-
9、反应4A(g)+2B(g)3C(g)+D(g),在不同条件下反应,其平均反应速率v(X)如下,其中反应速率最大的是( )A、v(A)=0.2mol·(L·s)-1 B、v(B)=6mol·(L·min)-1 C、v(C)=8mol·(L·min)-1 D、v(D)=4mol·(L·min)-1
-
10、奥沙那胺()是一种重要的药物,其合成路线如图所示:
 (1)、化合物i中官能团名称为;化合物是化合物i的同系物,其核磁共振氢谱有2组峰,且峰面积之比为9:1,的名称为(用系统命名法命名)。(2)、根据化合物ii的结构特征,分析其可能具有的化学性质,完成下表。
(1)、化合物i中官能团名称为;化合物是化合物i的同系物,其核磁共振氢谱有2组峰,且峰面积之比为9:1,的名称为(用系统命名法命名)。(2)、根据化合物ii的结构特征,分析其可能具有的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
足量的/催化剂,加热
 (3)、关于反应④,下列说法不正确的有____(填标号)。A、化合物iv中含有手性碳原子 B、化合物iv中所有碳原子可以共平面 C、反应过程中有双键的断裂和单键的形成 D、化合物中氧原子均采用杂化(4)、以乙醛为含碳原料,利用反应①和②的原理,合成化合物vi。
(3)、关于反应④,下列说法不正确的有____(填标号)。A、化合物iv中含有手性碳原子 B、化合物iv中所有碳原子可以共平面 C、反应过程中有双键的断裂和单键的形成 D、化合物中氧原子均采用杂化(4)、以乙醛为含碳原料,利用反应①和②的原理,合成化合物vi。
基于你设计的合成路线,回答下列问题:
(a)最后一步反应中,醇类有机反应物为(写结构简式)。
(b)相关步骤涉及反应①的原理,其化学方程式为。
(c)合成路线中生成能发生加聚反应的单体(羧酸类),其单体在催化剂的作用下,通过加聚反应生成高分子的化学方程式为。
-
11、纳米零价铁因其具有高比表面积、高反应活性和强还原性能,在水处理领域具有广阔的应用前景。(1)、基态铁原子的核外电子排布式是 , 从电子排布的角度分析比稳定的原因。(2)、纳米零价铁可以通过液相还原法,利用硼氢化物()还原溶液中的制备。
①发生反应的离子方程式为 , 当反应生成3molH2时,转移电子的物质的量为mol;
②在25℃,101kPa下,将①中生成的3mol完全燃烧生成液态水,释放的能量为kJ[已知该条件下,电解液态水生成1mol , 反应的]。
(3)、纳米零价铁也可以通过与反应制备,其反应为。一定温度下,将一定量的和置于恒容密闭容器中反应,下列能说明反应达到平衡状态的有____(填标号)。A、体系压强不再改变 B、 C、混合气体的密度不再改变 D、和的浓度之比为1:2(4)、纳米零价铁具有强的还原能力,酸性环境下,可将溶液中还原成固态的而除去,自身转化成。质量、状态均相同的纳米零价铁对三种同体积、不同初始浓度(单位:)溶液中的去除率如图所示。
①该反应的离子方程式为。
②初始浓度时,在0~4h内,的平均消耗速率为。
(5)、纳米零价铁也可用于去除水体中的六价铬污染物。可用纳米零价铁将水体中还原为 , 再将转化为从水体中除去。①常温下,总浓度为溶液中,含铬物种浓度随溶液的分布如图所示,则的=(用含、的式子表示)。

②实验发现,在纳米零价铁中添加少量铜粉,去除水体中六价铬的效率与纯纳米零价铁相比更高,其原因是。
-
12、工业常以黄铁矿(主要成分为)和软锰矿(主要成分为 , 杂质为、、、等元素的氧化物)为原料制备 , 其工艺流程如图所示。

已知:常温下,。相关金属离子形成氢氧化物沉淀的范围如下表所示:
金属离子
开始沉淀的
8.1
6.3
1.5
8.9
3.4
完全沉淀的
10.1
8.3
2.8
10.9
4.7
(1)、“酸浸”时,滤渣1的成分为和(填化学式)。(2)、“氧化”涉及主要反应的化学方程式为。该过程中可代替的物质是(填化学式,写一种即可)。 (3)、“调”的目的是除铁和铝,则调节的合理范围为。当铁恰好沉淀完全时,溶液中=。(4)、“除镁”时,若溶液太小会导致除镁不完全,试分析原因:。(5)、“沉锰”时,涉及主要反应的离子方程式为。(6)、一定温度下,向溶液中加入氨水,同时通入空气,可制得某种锰的氧化物,其立方晶胞结构及小立方体、的结构如下图所示,则该氧化物的化学式为。若晶胞密度为 , 为阿伏加德罗常数的值,则晶胞边长为nm(列出计算式即可)。
(3)、“调”的目的是除铁和铝,则调节的合理范围为。当铁恰好沉淀完全时,溶液中=。(4)、“除镁”时,若溶液太小会导致除镁不完全,试分析原因:。(5)、“沉锰”时,涉及主要反应的离子方程式为。(6)、一定温度下,向溶液中加入氨水,同时通入空气,可制得某种锰的氧化物,其立方晶胞结构及小立方体、的结构如下图所示,则该氧化物的化学式为。若晶胞密度为 , 为阿伏加德罗常数的值,则晶胞边长为nm(列出计算式即可)。 -
13、化学反应常伴随热效应。某实验小组同学研究反应热的测定,反应体系中热量变化用公式计算。
 (1)、Ⅰ.中和热的测定
(1)、Ⅰ.中和热的测定
小组同学用如图所示装置进行中和热测定,该装置缺少的仪器是。(2)、采用50mL稀盐酸与50mL溶液混合,常温下该混合溶液中由水电离的=(忽略混合后溶液体积的变化)。稍过量的原因是。(3)、Ⅱ.用作图法测定中和热及溶液浓度查阅资料:保持反应溶液不变,减小 , 增大 , 与成直线关系。
实验过程:改变约盐酸及溶液的体积,将酸、碱溶液混合,准确测定出温度变化如下表所示。
实验次序
1
2
3
4
5
6
7
8
9
10
/mL
50.0
45.0
40.0
35.0
30.0
25.0
20.0
15.0
10.0
5.0
/mL
0
5.0
10.0
15.0
20.0
25.0
30.0
35.0
40.0
45.0
/℃
0
1.2
2.5
3.8
5.1
5.7
4.8
3.6
2.4
1.2
数据分析:以为横坐标,为纵坐标,将1~5及6~10次实验数据分别作直线,延伸两直线交于一点,交点处。
两条直线交点处 , 则(填“>”“<”或“=”)5.7。计算出盐酸的浓度=(保留两位小数)。计算中和热=-(列出计算式即可,用含的式子表示,取 , 取 , 忽略水以外的物质吸收的热量以及混合后溶液体积的变化)。
(4)、Ⅲ.验证盖斯定律及测定电离焓实验试剂:盐酸、溶液、蒸馏水、固体。
每组实验均做3组,取的平均值得到下列表格:
实验序号
实验项目(混合物质组合)
(盐酸)/mL
(溶液)/mL
()/mL
(固体)/g
/℃
/()
1
溶液与盐酸
50
50
0
0
2
固体与蒸馏水
0
0
3
固体与盐酸
100
0
0
1.1
补充表格中数据:= , =。
(5)、实验结论:测得实验数据 , 通过计算得出≈(用含和的式子表示),即可验证盖斯定律。(6)、根据上述验证实验原理,结合实验1的中和热 , 设计实验测定醋酸电离()的焓变 , 该实验方案为。 -
14、科学家研制了以为活性材料的水系液流电池,充电时其工作原理如图所示。已知Nafion膜是一种特殊的质子交换膜,具有较高的质子传导率。下列说法不正确的是( )
 A、放电时,电极N是负极 B、放电时,总反应为 C、充电时,阴极室中溶液逐渐增大 D、充电时,若电极N上产物分别为和 , 则电路中转移相同数目的电子消耗的物质的量之比为1:2
A、放电时,电极N是负极 B、放电时,总反应为 C、充电时,阴极室中溶液逐渐增大 D、充电时,若电极N上产物分别为和 , 则电路中转移相同数目的电子消耗的物质的量之比为1:2 -
15、催化剂X和Y均能催化反应。反应历程如图所示,“·”表示反应物或生成物吸附在催化剂表面。其他条件相同时,下列说法不正确的是( )
 A、两个反应的反应历程都为3步 B、平衡时N的产率:反应Ⅱ>反应Ⅰ C、反应达到平衡后,降低温度,N的浓度增大 D、反应过程中,N·Y能达到的最大浓度大于N·X
A、两个反应的反应历程都为3步 B、平衡时N的产率:反应Ⅱ>反应Ⅰ C、反应达到平衡后,降低温度,N的浓度增大 D、反应过程中,N·Y能达到的最大浓度大于N·X -
16、由非金属元素组成的化合物可用于治疗心绞痛,且Y、X、E、M、Z原子序数依次增大。Y的原子核外电子只有一种自旋取向,X的一种核素常用于测定文物的年代,M的基态原子价层电子排布为 , Z的简单离子不影响水的电离平衡。下列说法正确的是( )A、元素电负性:X<Y<Z B、简单氢化物沸点:E>M>X C、第一电离能:X<E<M D、和的空间结构不相同
-
17、下列实验操作、现象及解释均正确的是( )
选项
操作
现象
现象解释
A
将浓硫酸加入盛有固体的试管中,加热
试管口有白雾出现
酸性:
B
向盛有无色溶液的试管中滴加几滴溶液,将湿润的试纸放在试管口
试纸无变化
溶液中不含
C
向盛有甲苯的试管中滴加几滴酸性溶液,振荡
酸性溶液褪色
甲苯中含有碳碳双键
D
向溶液中加入一定量固体
溶液由蓝色变为绿色
A、A B、B C、C D、D -
18、下列操作所涉及的离子方程式书写正确的是( )
选项
操作
离子方程式
A
用酸性溶液滴定溶液
B
将过量溶液与澄清石灰水混合
C
电解溶液
D
用稀硝酸鉴别铜合金制成的假金币
A、A B、B C、C D、D -
19、每年的10月23日上午6:02到下午6:02被誉为“摩尔日”。设为阿伏加德罗常数的值,下列说法正确的是( )A、1mol含有的电子数目为 B、28g与44g含有的键数目相同 C、1L的溶液中,数目为 D、标准状况下,2.24L溶于足量水中转移的电子数目为
-
20、部分含物质的分类与相应化合价如图所示。下列说法不正确的是( )
 A、实验室常用排空气法收集 B、能使酸性高锰酸钾溶液褪色 C、铜单质与反应,产物中铜元素化合价为+2 D、的溶液中通入足量的氧气可以变成e的溶液
A、实验室常用排空气法收集 B、能使酸性高锰酸钾溶液褪色 C、铜单质与反应,产物中铜元素化合价为+2 D、的溶液中通入足量的氧气可以变成e的溶液