-
1、下列实验装置及操作完全正确的是( )




A.测定锥形瓶中污水样品中c(OH-)
B.制备O2
C.验证牺牲阳极法保护铁
D.关闭a,打开b,可检查装置的气密性
A、A B、B C、C D、D -
2、部分含镁或含铜物质的分类与相应化合价关系如图所示,其中e为氯化物。下列推断合理的是( )
 A、a、b、c、d、e不可能均为含铜物质 B、c、d可以在不同条件下互相转化 C、工业上均采取电解e水溶液的方式冶炼a D、c为含铜物质时,可以在加热条件下氧化乙醇
A、a、b、c、d、e不可能均为含铜物质 B、c、d可以在不同条件下互相转化 C、工业上均采取电解e水溶液的方式冶炼a D、c为含铜物质时,可以在加热条件下氧化乙醇 -
3、氨广泛应用于化工、化肥、制药等领域,一种新型合成方法如下。下列说法错误的是( )
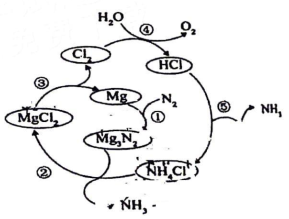 A、反应①属于人工固氮 B、反应②为氧化还原反应 C、该转化过程总反应为:2N2+6H2O=4NH3+3O2 D、反应⑤在无水环境中进行时有白烟产生
A、反应①属于人工固氮 B、反应②为氧化还原反应 C、该转化过程总反应为:2N2+6H2O=4NH3+3O2 D、反应⑤在无水环境中进行时有白烟产生 -
4、符号表征是化学学习不可或缺的媒介和工具,如水的分子式H2O,氢氧根离子符号OH-。下列化学用语或图示表达正确的是( )A、NH3的VSEPR模型为
 B、HClO的电子式为
B、HClO的电子式为 C、2pz电子云图为
C、2pz电子云图为 D、基态氧原子的电子排布图为
D、基态氧原子的电子排布图为
-
5、科学生产中蕴藏着丰富的化学知识。下列劳动项目与所述的化学知识没有关联的是( )
选项
劳动项目
化学知识
A
食用盐中加碘酸钾
补充碘元素,预防甲状腺机能亢进
B
将小苏打加入面粉中焙制糕点
小苏打属于酸式盐,可以与碱反应
C
使用复合肥料培育植物
复合肥含N、P、K三种元素中的两种或三种
D
盐碱地(含较多Na2CO3等)施用适量石膏,降低土壤的碱性
盐与盐发生复分解反应
A、A B、B C、C D、D -
6、化学与生活息息相关,下列说法错误的是( )A、油脂碱性条件下的水解反应可用于生产肥皂 B、CuSO4会使体内的蛋白质变性从而失去生理活性 C、纤维素在人体内可水解成葡萄糖,供人体组织的营养需要 D、葡萄糖能发生银镜反应
-
7、潮州是中国历史文化名城之一,潮州文化是岭南文化的重要组成部分,是中华文化的重要支脉。下列材料主要成分是硅酸盐的是( )A、潮州木雕
 B、潮州小吃红桃棵
B、潮州小吃红桃棵 C、潮州大鼓
C、潮州大鼓 D、潮州瓷器
D、潮州瓷器
-
8、F是合成吡啶类农药的重要中间体,其主要合成路线如下:
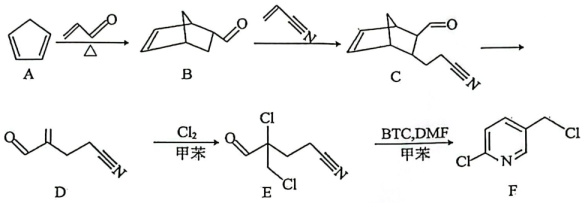 (1)、B的分子式为 , 其环上的含氧取代基是(写名称)。化合物H是B的同分异构体,分子中含有苯环,核磁共振氢谱上有4组峰,峰面积比为 , 则H的结构简式为(写一种)。(2)、关于B→C的反应,下列说法不正确的是____。A、该反应属于加成反应 B、反应过程中有碳原子由杂化转变为杂化 C、化合物B和C均有3个手性碳原子 D、化合物B易溶于水(3)、根据化合物E的结构特征,分析预测其可能的化学性质,完成下表。
(1)、B的分子式为 , 其环上的含氧取代基是(写名称)。化合物H是B的同分异构体,分子中含有苯环,核磁共振氢谱上有4组峰,峰面积比为 , 则H的结构简式为(写一种)。(2)、关于B→C的反应,下列说法不正确的是____。A、该反应属于加成反应 B、反应过程中有碳原子由杂化转变为杂化 C、化合物B和C均有3个手性碳原子 D、化合物B易溶于水(3)、根据化合物E的结构特征,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
示例
, 酸性
还原反应
a
水解反应
b
氧化反应(生成有机产物)
(4)、参考以上合成路线,以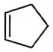 和乙烯为原料设计制备
和乙烯为原料设计制备 的合成路线(无机试剂和有机溶剂任用,有机物用结构简式表示)。
的合成路线(无机试剂和有机溶剂任用,有机物用结构简式表示)。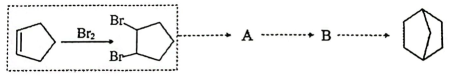
①相关反应涉及到卤代烃的消去反应,其化学方程式为。
②最后一步反应中,有机反应物B为(写结构简式)。
-
9、研究资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。已知:
反应Ⅰ.
反应Ⅱ.
反应Ⅲ.
(1)、低温自发的反应是(填反应序号)。(2)、温度下(为气态),向恒容密闭容器中充入和 , 发生上述反应,下列表明反应Ⅱ已经达到平衡状态的是____。A、压强保持不变 B、与的物质的量之比为 C、混合气体的密度保持不变 D、混合气体的平均相对分子质量保持不变(3)、时,反应Ⅰ的速率方程为 , 其中x表示相应气体的物质的量分数,为平衡常数(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),k为反应的速率常数。已知保持不变,达到平衡时, , 此时反应Ⅰ的速率(用含k的代数式表示)。(4)、其他条件相同时,使用两种不同催化剂进行反应,相同时间内测得转化率、选择性随温度变化的影响分别如图1、图2所示:图1
 图2
图2
①结合图像,工业上应选择的催化剂种类及合适温度为。
②以Ni为催化剂,温度高于320℃时,转化率随温度升高上升,原因是。
(5)、催化电解吸收的溶液可将转化为有机物。在相同条件下,通过电解池的电量恒定,电解得到部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示。
已知:FE%=×100%,其中 , n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
①当电解电压为时,电解过程中含碳还原产物的FE%为0,阴极主要还原产物为(填化学式)。
②当电解电压为时,阴极由生成的电极反应式为。
③当电解电压为时,电解生成的和的物质的量之比为。
-
10、铟(In)是一种稀散金属,常与其他金属矿石伴生,从氧化锌烟尘(主要成分是 , 还含少量、、、等)中回收金属铟的工艺流程如下:
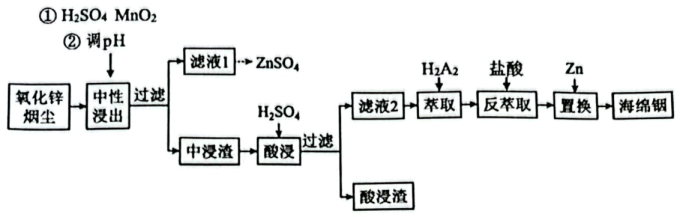
已知:常温下,;;;。
(1)、铟位于元素周期表第五周期第ⅢA族,其价层电子排布式为。(2)、中性浸出进行步骤①时的硫元素被氧化为 , 该反应的化学方程式为。(3)、调pH后“中浸渣”的主要成分除含、外,还有(写化学式)。已知溶液中离子浓度小于等于时,视为沉淀完全,常温下调pH为6时是否完全沉淀。(请填“是”或“否”)(4)、已知“萃取”时存在平衡(有机液)(有机液) , 请写出提高反萃取率的一项措施。(5)、写出“置换”工序发生反应的离子方程式。(6)、磷化铟晶体属于立方晶系,其晶胞结构如图所示,晶胞参数为。晶体中In的配位数为 , 晶体密度为(列出计算式,不必化简,为阿伏加德罗常数的值)。
-
11、镁是一种活泼金属,常温下能与水缓慢反应。某实验小组将打磨后的镁条投入滤液中,发现立即产生大量气泡,实验探究原因。(1)、重复实验:配制溶液,除托盘天平、烧杯、量筒、玻璃棒外,还需用到的玻璃仪器有 , 保存时需注意。向溶液中加入溶液,产生白色沉淀后过滤,得到滤液。取少许滤液,投入打磨后的镁条,快速产生大量气泡。(2)、实验探究镁与滤液快速产生气体的原因。
【查阅资料】体积较小的阴离子,能够“钻入”膜,达到使其溶解的效果。对该反应无影响。
【提出猜想】可能是或促进镁与水的反应。
【实验探究】完成下列表格。
序号
实验操作
实验现象
Ⅰ
将打磨后的镁条投入水中
细微气泡附着
Ⅱ
将打磨后的镁条投入溶液中
细微气泡附着
Ⅲ
将打磨后的镁条投入中
细小气泡放出
(3)、【实验结论】能促进镁与水的反应,溶液中离子无影响。对比发现镁与滤液的反应速率比实验Ⅲ更快。经讨论,猜想滤液中存在微量银离子,可能形成了微小原电池,进一步加快反应速率。
【提出猜想】和共同加快镁与水反应速率。
【实验探究】将微观原电池放大,设计宏观原电池装置以证明猜想。甲组实验过程如下表所示,表中液体X为 , 液体Y为。
序号
Ⅳ
Ⅴ
Ⅵ
装置



溶液
液体X
溶液
液体Y
(4)、【实验结论】观察到现象 , 证明是和共同加快镁与水反应速率。(5)、乙组设计实验Ⅵ使用如图所示装置(其他与甲组相同),甲组同学认为不合理,该组同学的理由是。
-
12、我国研发的“无淡化海水原位直接电解制氢技术”装置如图所示,阴、阳极材料均为附着有的催化电极网,表面的可选择性地紧密结合水电离出的。下列说法不正确的是( )。
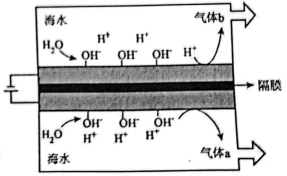 A、气体b为 B、负电层可减少副产物的生成 C、等电极垢在阳极产生,应定期更换 D、与海水淡化间接制氢相比,原位直接制氢成本低
A、气体b为 B、负电层可减少副产物的生成 C、等电极垢在阳极产生,应定期更换 D、与海水淡化间接制氢相比,原位直接制氢成本低 -
13、黄铵铁矾能催化形成自由基(过程可能的机理如图所示),氧化去除废水中的偶氮染料。下列说法不正确的是( )。
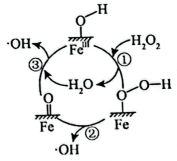 A、图中
A、图中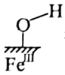 指黄铵铁矾
B、图所示过程可生成
C、反应③有极性共价键的断裂和形成
D、温度越高,偶氮染料去除率越大
指黄铵铁矾
B、图所示过程可生成
C、反应③有极性共价键的断裂和形成
D、温度越高,偶氮染料去除率越大
-
14、下表中陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是( )。
选项
陈述Ⅰ
陈述Ⅱ
A
石英坩埚可用于熔融烧碱
熔点高
B
氨是工业制硝酸的原料
具有还原性
C
铜与稀硝酸反应,试管上方气体变红
NO为红棕色气体
D
可用于除去工业废水中的
是难溶物
A、A B、B C、C D、D -
15、已知前四周期元素X、Y、Z、R的原子序数依次增大。X是最轻的元素,Y的p轨道比s轨道少2个电子,Z与Y同周期,Z的最简氢化物水溶液呈碱性,R元素常被称为“21世纪金属”,广泛用作航空材料。元素Y和R组成的某气态团簇分子结构如图所示。下列说法正确的是( )。
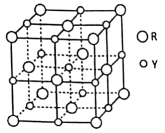 A、最简氢化物熔沸点比较:Y<Z B、元素X分别与Y、Z组成的常见化合物均为极性分子 C、基态Y、Z原子核外电子均有5种空间运动状态 D、该气态团簇分子的分子式为RY
A、最简氢化物熔沸点比较:Y<Z B、元素X分别与Y、Z组成的常见化合物均为极性分子 C、基态Y、Z原子核外电子均有5种空间运动状态 D、该气态团簇分子的分子式为RY -
16、物质间转化有规律。下列方程式符合规律且正确的是( )。A、酸性氧化物+水→酸: B、较强酸+较弱酸盐→较弱酸+较强酸盐: C、酸+碱→盐+水: D、活泼金属+水→碱+氢气:
-
17、某化学小组用“84消毒液”(主要成分为)制备氯气并探究其性质,如图所示进行实验(a~d为浸有相应试液的棉花,夹持装置省略)。下列说法正确的是( )。
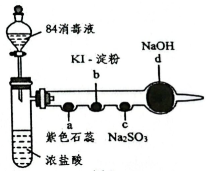 A、具支试管中产生黄绿色气体,体现了浓盐酸的挥发性 B、a处棉花变红而不褪色 C、b处棉花变为蓝色,说明氧化性: D、c处无明显现象,说明未发生化学反应
A、具支试管中产生黄绿色气体,体现了浓盐酸的挥发性 B、a处棉花变红而不褪色 C、b处棉花变为蓝色,说明氧化性: D、c处无明显现象,说明未发生化学反应 -
18、设为阿伏加德罗常数的值。与性质相似,可作为水产养殖中的供氧剂,一般由悬浊液与溶液反应制得。下列叙述正确的是( )。A、含有极性键 B、含阴阳离子总数为 C、的溶液,的数目为 D、与水反应生成转移电子数目为
-
19、如图为铜或镁元素的部分价类二维图,下列叙述不正确的是( )。
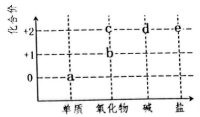 A、可能存在a→d→e的直接转化 B、d可能溶于过量的氨水 C、若新制的d能用于检验醛基,则此时生成b D、蒸干c的水溶液均能得到原溶质
A、可能存在a→d→e的直接转化 B、d可能溶于过量的氨水 C、若新制的d能用于检验醛基,则此时生成b D、蒸干c的水溶液均能得到原溶质 -
20、磷酸铁锂超充电池开启新能源汽车超充时代。下列说法正确的是( )。A、Li作原电池正极 B、该电池是一次电池 C、充电时由正极移向负极 D、充电时发生反应: