-
1、水合肼()是一种强还原性的碱性液体,常用作火箭燃料。利用尿素法生产水合肼的原理为。

甲 乙
(1)、实验1:制备溶液(已知:)。
图甲装置Ⅰ中烧瓶内发生反应的离子方程式为。(2)、用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器有。(3)、图甲装置Ⅱ中用冰水浴控制温度的目的是。(4)、实验2:制取水合肼图乙中若分液漏斗滴液速度过快,部分会参与A中反应并产生大量氮气,降低产品产率,该过程中反应生成氮气的化学方程式为。充分反应后,蒸馏A中溶液即可得到水合肼的粗产品。
实验3:测定馏分中水合肼的含量
(5)、称取馏分3.0g,加入适量固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液。用的碘的标准溶液滴定。(已知:)①该实验滴定终点的判断:
②滴定操作中若不加入适量固体,则测量结果会(填“偏大”“偏小”“无影响”)。
③下列能导致馏分中水合肼的含量测定结果偏高的是(填字母)。
a.锥形瓶清洗干净后未干燥 b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视 d.盛标准液的滴定管水洗后,直接装标准液
④实验测得消耗溶液的平均值为20.00mL,馏分中水合肼()的质量分数为。
-
2、已知草酸()为二元弱酸,在室温下,向一定浓度的草酸溶液中逐滴加入一定浓度的KOH溶液,溶液中、、三种微粒分别在三者中所占的物质的量分数()与溶液pH的关系如图所示。下列说法中正确的是( )
 A、室温时,的水解平衡常数 B、当溶液时, C、当溶液时, D、A点溶液加水稀释,则水的电离程度减小
A、室温时,的水解平衡常数 B、当溶液时, C、当溶液时, D、A点溶液加水稀释,则水的电离程度减小 -
3、一种新型的锂—空气二次电池的工作原理如图所示。下列说法中错误的是( )
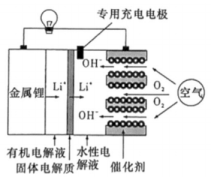 A、电路中有2mol电子通过时,水性电解液的质量增加16g B、催化剂可以吸附氧气,促进氧气得电子发生还原反应 C、电池充电时,电子从电源负极流向锂电极,锂电极作阴极 D、固体电解质既可以传递离子又可以起到隔膜的作用
A、电路中有2mol电子通过时,水性电解液的质量增加16g B、催化剂可以吸附氧气,促进氧气得电子发生还原反应 C、电池充电时,电子从电源负极流向锂电极,锂电极作阴极 D、固体电解质既可以传递离子又可以起到隔膜的作用 -
4、五种短周期主族元素X、Y、Z、M、Q的原子序数依次增大,X的2p轨道半充满,Y的s能级电子数和p能级电子数相等,Z是至今发现的电负性最大的元素,M在元素周期表中处于周期序数等于族序数的位置,Q的单质被广泛用作半导体材料。下列叙述中不正确的是( )A、元素的第一电离能: B、气态氢化物的稳定性: C、气态氢化物分子的键角: D、最高价氧化物对应的水化物的酸性:
-
5、下列实验操作,现象与结论匹配的是( )
选项
操作
现象
结论
A
将缠绕铜丝灼烧后反复插入盛乙醇的试管,然后滴入酸性高锰酸钾溶液
酸性高锰酸钾溶液褪色
乙醇催化氧化生成乙醛
B
将装有的平衡球放入热水中
颜色加深
C
向含的溶液中通入 , 再滴加淀粉溶液
溶液变蓝色
还原性:
D
向碳酸钠溶液中加入稀硫酸,反应产生的气体通入苯酚钠溶液中
溶液变浑浊
酸性:碳酸苯酚
A、A B、B C、C D、D -
6、氢气与氮气在固体催化剂表面合成氨的过程如下图所示。

① ② ③ ④ ⑤
下列说法错误的是( )
A、②→③释放能量 B、为了提高氨的脱附速率,应适时地将氨从反应后的混合气体中分离出来 C、该过程中包含旧化学键的断裂和新化学键的生成 D、该催化剂可提高单位时间生成物的产率 -
7、不能说明氯的非金属性强于溴的事实是( )A、酸性强于 B、的分解温度低于 C、溶液中滴少量氯水,溶液变黄 D、中氯为价
-
8、下列表示不正确的是( )A、羟基的电子式:
 B、氯乙烯的结构简式:
C、基态亚铁离子的电子排布式:
D、分子的球棍模型:
B、氯乙烯的结构简式:
C、基态亚铁离子的电子排布式:
D、分子的球棍模型: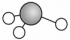
-
9、为阿伏加德罗常数的值。下列说法正确的是( )A、常温常压下,4.48L CO中含有的分子数为 B、稀盐酸中,氢原子的数目为 C、在足量中燃烧,消耗时,转移的电子数为 D、标准状况下,含有的原子数为
-
10、向下列溶液中逐渐通入至过量,最终体系中无沉淀的是( )A、、、、 B、、、、 C、、、、 D、、、、
-
11、下列化学反应的离子方程式正确的是( )A、在中投入固体: B、向溶液中加入过量的浓氨水: C、向溶液中通入少量: D、溶于稀硝酸的反应:
-
12、下列过程中,涉及化学变化的是( )A、用黏土制作陶坯 B、甘油加水作护肤剂 C、用熟苹果催熟猕猴桃 D、用四氯化碳擦去圆珠笔油渍
-
13、我国力争在2030年前实现碳达峰,2060年前实现碳中和。将二氧化碳资源化尤为重要。(1)、CO2可与H2制甲醇:在催化剂作用下,发生以下反应:
Ⅰ. CO2(g) + 3H2(g) ⇌ CH3OH(g) + H2O(g)
Ⅱ. CO2(g) + H2(g) ⇌ CO(g) + H2O(g)
①则:III.CO(g) + 2H2(g) ⇌ CH3OH(g) △H3=。
②若将等物质的量的CO和H2充入恒温恒容密闭容器中进行上述反应III,下列事实能说明此反应已达到平衡状态的是。
A.生成CH3OH的速率与生成H2的速率相等 B.CO和H2的物质的量之比为定值
C.混合气体的平均相对分子质量不变 D.容器内气体密度保持不变
E.CO的体积分数保持不变
③将CO2与H2充入装有催化剂的密闭容器中,发生反应Ⅰ和Ⅱ。CO2的转化率和CO、CH3OH的产率随反应温度的变化如图所示。由图判断合成CH3OH最适宜的温度是;高于该温度后,随着温度的升高CH3OH的产率发生变化的主要原因是。(答两点)
 (2)、CO2可与NH3制尿素:2NH3(g) + CO2(g) ⇌ CO(NH2)2(s) + H2O(g) △H=-87 kJ/mol。研究发现,合成尿素的反应分两步进行。
(2)、CO2可与NH3制尿素:2NH3(g) + CO2(g) ⇌ CO(NH2)2(s) + H2O(g) △H=-87 kJ/mol。研究发现,合成尿素的反应分两步进行。第1步:2NH3(g) + CO2(g) ⇌ NH2COONH4(s)
第2步:NH2COONH4(s) ⇌ CO(NH2)2(s) + H2O(g) △H2 = +72.47kJ﹒mol-1
①一定条件下,向刚性容器中充入3 mol NH3和4 mol CO2 , 平衡时CO2的体积分数为60%,则平衡时NH3的转化率α(NH3)=(保留一位小数),此条件下,第2步反应的Kp=a kPa,则反应2NH3(g) + CO2(g) ⇌ CO(NH2)2(s) + H2O(g) 的平衡常数Kp=(kPa)-2。
②若要加快反应速率并提高NH3平衡转化率,可采取的措施有(任写一条)。
-
14、氧化钴(Co2O3)在工业、电子、电讯等领域都有着广阔的应用前景。以铜钴矿石(主要成分为和 , 还有的氧化物)为原料制备氧化钴的工艺流程如图所示:

已知:常温下;完全沉淀的pH约为3.2。
请回答下列问题:
(1)、“浸泡”过程中,所得滤渣1中的物质是 , 写出此过程中与反应的离子方程式。(2)、“除铜”过程中需加入FeS固体,写出该过程发生反应的离子方程式。(3)、为检验除铜后滤液中是否含有 , 取少量滤液,滴加2滴。溶液,反应的现象为产生特征的蓝色沉淀,其反应的离子方程式为:。(4)、过程Ⅰ加入溶液调节至4.0左右,其目的为。(5)、已知某温度下。该温度下,步骤Ⅱ中加入足量的溶液可将沉淀除去,若所得滤液中 , 则滤液中为。(6)、工业上采取电解精炼制取时,常选用COCl2为电解质溶液进行电解,“粗钴”应与电源(填“正”或“负”)极相连,另一极为石墨电极,则阴极的电极反应为;Co元素位于元素周期表的区。 -
15、I.某学生用标准溶液滴定未知浓度盐酸时,选择甲基橙作指示剂。请回答下列问题:
 (1)、若滴定开始和结束时,碱式滴定管中的液面如图1,则消耗标准液的体积为mL。(2)、下列有关实验的说法不正确的是____。
(1)、若滴定开始和结束时,碱式滴定管中的液面如图1,则消耗标准液的体积为mL。(2)、下列有关实验的说法不正确的是____。图2
 图3
图3 A、用酸式滴定管取稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再滴加几滴甲基橙试液进行 滴定 B、滴定前,锥形瓶和滴定管均须用标准溶液润洗 C、将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移 D、为除去碱式滴定管底部的气泡,应挤压玻璃球快速放出碱液,最后采用图2中的丙操作
A、用酸式滴定管取稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再滴加几滴甲基橙试液进行 滴定 B、滴定前,锥形瓶和滴定管均须用标准溶液润洗 C、将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移 D、为除去碱式滴定管底部的气泡,应挤压玻璃球快速放出碱液,最后采用图2中的丙操作使尖嘴处充满碱液
E、滴定前碱式滴定管尖嘴部分有气泡,滴定后气泡消失,测定盐酸的物质的量浓度偏高 F、根据图3中突变范围,选择甲基橙作指示剂时所产生的误差最小(3)、某学生实验中记录的有关数据如下表:滴定次数
待测盐酸体积/mL
标准溶液体积
滴定前刻度/mL
滴定后刻度/mL
第1次
25.00
0.00
26.11
第2次
25.00
1.56
29.61
第3次
25.00
0.22
26.31
依据表中数据,计算盐酸的物质的量浓度为。
(4)、II.氧化还原滴定实验与酸碱中和滴定类似。某学生用“间接硝量法”测定含有晶体的试样纯度(不含与发生反应的氧化性杂质)。过程如下:取0.36g试样溶于水,加入过量固体,充分反应:。用标准溶液滴定: , 到达滴定终点时,消耗标准溶液。选用作滴定指示剂,滴定终点的现是。
(5)、该试样中的质量分数为。 -
16、按要求完成下列试题:
Ⅰ.电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)、已知部分弱酸的电离常数如表:弱酸
HCN
电离常数(25℃)
①0.1 mol·L-1NaCN溶液和0.1 mol·L-1NaHCO3溶液中,(填“>”“<”或“=”)。
②常温下,pH相同的三种溶液:A. B.NaCN C. , 其物质的量浓度由大到小的顺序是(填编号)。
③室温下,一定浓度的溶液pH=9,溶液中=。
④将少量通入NaCN溶液,反应的离子方程式是。
(2)、室温下,通入NaOH溶液中,在所得溶液中 , 溶液的pH=。(室温下,的;)(3)、II.元素A、B、C、D都是短周期元素,A元素原子的2p轨道上仅有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是同周期中电负性最大的,D的气态氢化物的水溶液能使无色酚酞试液变红。试回答:A的最外层电子轨道表示式为;B的原子核外电子运动状态有种,
(4)、C的最外层电子排布式为;D的原子结构示意图为。 -
17、25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是( )
 A、图中a=2.6 B、25℃时,HCO3-+H2OH2CO3+OH-的Kh=1.0×10-6.4 C、M点溶液中: D、若要表示题目条件下pH与lg的变化关系.则曲线应该在平行于曲线的下方
A、图中a=2.6 B、25℃时,HCO3-+H2OH2CO3+OH-的Kh=1.0×10-6.4 C、M点溶液中: D、若要表示题目条件下pH与lg的变化关系.则曲线应该在平行于曲线的下方 -
18、恒温恒压下向密闭容器中充入4mol SO2和2mol O2 , 反应如下:2SO2(g)+O2(g) ⇌ 2SO3(g) ΔH<0,2min时反应达到平衡,生成1.4mol SO3 , 同时放出热量QkJ。则下列分析正确的是( )A、若反应开始时容器体积为2L,则0~2min内v(SO3)=0.35mol/(L·min) B、2min后向容器中再通入一定量的SO3气体,重新达到平衡时,SO2的含量增大 C、若把条件“恒温恒压”改为“绝热恒压”,则平衡后n(SO3)大于1.4mol D、若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于QkJ
-
19、结合已有知识,根据下列实验操作,其对应的现象和结论均正确的是( )
选项
实验操作
现象
结论
A
将Mg片和Al片用导线相连后,同时插入NaOH溶液中
Mg片上产生气泡
原电池中正极可能是化学性质活泼的金属
B
向2支分别盛有5mL 0.1 mol·L-1、5mL 1 mol·L-1 NaHSO3溶液的试管中同时加入溶液(过量)
均有气泡产生且溶液产生气泡快
浓度大的溶液反应速率快
C
CuS的悬浊液中加入饱和溶液
生成浅红色沉淀(MnS为浅红色)
D
相同条件下,分别测量浓度为和的醋酸溶液的导电性
醋酸溶液导电性强
弱电解质浓度越大,电离程度越大
A、A B、B C、C D、D -
20、下图是计算机模拟的在催化剂表面上水煤气变化的反应历程。吸附在催化剂表面的物种用“*”标注。
下列说法正确的是( )
 A、①表示CO和从催化剂表面脱离的过程 B、②和④中化学键变化相同,因此吸收的能量相同 C、相同条件下,反应速率:④>② D、由图可知为吸热反应
A、①表示CO和从催化剂表面脱离的过程 B、②和④中化学键变化相同,因此吸收的能量相同 C、相同条件下,反应速率:④>② D、由图可知为吸热反应