-
1、科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大.常温下,Z的氢化物是强酸,且Z与Y位于不同周期.下列有关叙述正确的是( )
 A、元素的最高正价: B、氢化物的沸点: C、Z的氧化物对应的水化物是强酸 D、Y的某种单质具有杀菌消毒作用
A、元素的最高正价: B、氢化物的沸点: C、Z的氧化物对应的水化物是强酸 D、Y的某种单质具有杀菌消毒作用 -
2、完成下列实验目的所进行的实验操作及现象均正确的是( )
选项
实验目的
实验操作及现象
A
鉴别和溶液
取少量溶液于试管中,分别滴加溶液,有白色沉淀产生的是溶液
B
探究维生素C的还原性
向溶液中滴加维生素C溶液,溶液由黄色变为浅绿色
C
观察的焰色
将铂丝用稀硫酸洗涤后,在酒精灯上灼烧,然后蘸取待测液,在火焰上灼烧、观察.
D
验证金属性:
取等物质的量的和 , 分别与足量的稀盐酸反应,产生的比多
A、A B、B C、C D、D -
3、甲~戊均为短周期元素,在元素周期表中的相对位置如图所示.戊的最高价氧化物对应的水化物为强酸.下列说法不正确的是( )
 A、离子半径:丁>戊>乙 B、单质与氢气化合的剧烈程度:戊>丁>丙 C、甲和乙一定可以形成“甲乙”、“”两种化合物 D、丙的最高价氧化物对应的水化物一定能与强碱反应
A、离子半径:丁>戊>乙 B、单质与氢气化合的剧烈程度:戊>丁>丙 C、甲和乙一定可以形成“甲乙”、“”两种化合物 D、丙的最高价氧化物对应的水化物一定能与强碱反应 -
4、下列实验装置不能达到实验目的的是( )
 A、图1:制备并观察氢氧化亚铁 B、图2:脱脂棉燃烧证明过氧化钠与水反应放热 C、图3:验证和的热稳定性 D、图4:验证非金属性(已知硅酸为白色沉淀)
A、图1:制备并观察氢氧化亚铁 B、图2:脱脂棉燃烧证明过氧化钠与水反应放热 C、图3:验证和的热稳定性 D、图4:验证非金属性(已知硅酸为白色沉淀) -
5、已知核内共有N个中子,R的质量数为A,则中含有电子的物质的量为( )A、 B、 C、 D、
-
6、价类二维图是学习元素及其化合物知识的重要模型.如图为氯元素的价类二维图,有关说法不正确的是( )
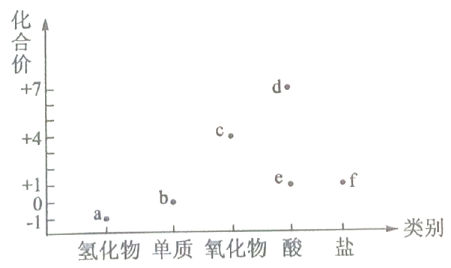 A、转化均为氧化还原反应 B、c是一种新的自来水消毒剂 C、d是一种酸性比硫酸强的强酸 D、f中氯元素化合价低,没有强氧化性
A、转化均为氧化还原反应 B、c是一种新的自来水消毒剂 C、d是一种酸性比硫酸强的强酸 D、f中氯元素化合价低,没有强氧化性 -
7、下列物质之间的转化,不能通过化合反应一步实现的是( )A、 B、 C、 D、
-
8、下列离子方程式或离子共存正确的是( )A、含的溶液中:可以大量共存 B、氯气和水反应: C、向氯化钙溶液中通入 D、与铝反应生成的溶液中可能大量存在
-
9、用表示阿伏加德罗常数的值.下列说法正确的是( )A、中含有的电子数目为 B、标准状况下,氢氟酸中含有的分子数目为 C、和混合气体中含有氧原子的数目为 D、和充分反应,转移电子数目为
-
10、下列关于氧化还原反应的说法错误的是( )A、氧化还原反应的本质是有元素化合价的升降 B、有单质参与的反应不一定是氧化还原反应 C、发生氧化反应的物质也可能同时发生还原反应 D、物质越容易得到电子,该物质的氧化性越强
-
11、分类法是学习化学的重要方法,下列分类正确的是( )A、碱性氧化物:氧化钙、氧化镁、氧化铝 B、有机高分子材料:合成纤维、塑料、橡胶 C、非电解质:二氧化硫、酒精、乙酸 D、胶体:墨水、鸡蛋清、碳酸钠溶液
-
12、关于的有关说法中正确的是( )A、固体不导电,是因为固体中没有离子存在 B、在水合离子中,水分子都应该是氧原子朝内 C、固体溶于水后,会形成水合钠离子和水合氯离子 D、的电离可表示为 , 该过程需要通电
-
13、用化学用语表示中的相关微粒,其中正确的是( )A、分子中含有非极性键 B、的电子式:
 C、的结构式:
D、的结构示意图:
C、的结构式:
D、的结构示意图:
-
14、化学与我们的生产、生活、环境保护等密切相关.下列说法错误的是( )A、植树造林有利于实现“碳达峰、碳中和” B、含有食品添加剂的食物对人体健康有害,不可食用 C、利用焰色试验的原理可以制成节日烟花 D、医用酒精凝胶中的乙醇属于有机化合物
-
15、钇及其化合物在航天、电子、超导等方面有着广泛的应用,工业上以硅铍钇矿为原料生产氧化钎 .(1)、钇与钪同族,位于元素周期表中钪的下一周期,基态钎原子的价电子排布图为 , 与元素同周期的基态原子中,未成对电子数与原子相同的元素还有种 .(2)、在元素周期表中,和处于第二周期和第三周期的对角线位置,化学性质相似.
①写出的最高价氧化物对应水化物与烧碱溶液反应的离子方程式: .
②已知元素和元素的电负性分别为1.5和4.0,则它们形成的化合物是(填“离子化合物”或“共价化合物”).
(3)、与均为第二周期元素:①元素的原子核外共有种不同空间运动状态的电子.
②电离能 , 原因是 .
-
16、党的十九届五中全会把碳达峰、碳中和作为“十四五”规划和2035年远景目标,研究的利用对实现碳达峰、碳中和具有重要意义.
图一
 图二
图二 (1)、我国科研人员研制出的可充电“”电池,以钠䈌和多壁碳纳米管(MWCNT)为电极材料,总反应为 . 放电时该电池“吸入” , 其工作原理如图一所示:
(1)、我国科研人员研制出的可充电“”电池,以钠䈌和多壁碳纳米管(MWCNT)为电极材料,总反应为 . 放电时该电池“吸入” , 其工作原理如图一所示:①放电时,正极产物全部以固体形式沉积在电极表面,正极的电极反应式为 .
②放电时,当转移-时,负极质量减少g.
(2)、华盛顿大学的研究人员研究出一种方法,可实现水泥生产时零排放,其基本原理如图二所示:①上述生产过程的能量转化方式是 .
②上述电解反应在温度小于时进行,碳酸钻先分解为和 , 电解质为熔融碳酸钠,则阳极放电的电极反应式为 .
-
17、2021年我国制氢量位居世界第一,煤气化制氢途径的原理如下:
Ⅰ.
Ⅱ.
回答下列问题:
(1)、(2)、一定温度下,向体积固定的密闭容器中加入足量的和 , 起始压强为 , 发生煤气化制氢反应.①反应Ⅰ的平衡常数表达式 .
②平衡时向容器中充入情性气体,平衡移动(填“正向”“逆向”或“不”,下同),加入固体 , 平衡移动.
③下列能说明反应Ⅰ到达平衡状态的是 .
A.混合气体的密度保持不变 B.容器内的压强保持不变
C.的体积保持不变 D.断裂的同时,生成键
(3)、常温下,保持压强为不变,向密闭容器中加入足量的和 , 反应达平衡时,物质的量为的物质的量为;反应Ⅱ的平衡常数(以分压表示,分压=总压×物质的量分数)(4)、时,潮湿的石膏雕像表面会发生反应: , 其平衡常数 . [已知] -
18、酸、碱、盐都是电解质,常温下,有以下电解质溶液:
① ② ③ ④ ⑤ ⑥ ⑦
已知:的电离常数
(1)、用化学用语解释④呈酸性的原因:(2)、的溶液①中由水电离出的为(3)、浓度均为的上述②③④三种溶液,由大到小为 -
19、通过滴加相同浓度的盐酸或溶液来调节溶液的 , 实验测得含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的关系如图所示:

下列有关说法正确的是( )
A、溶于水,所得溶液中的水解程度小于其电离程度 B、的数量级为 C、水的电离程度:点大于点 D、点溶液中存在: -
20、用酚䣭作指示剂,以的溶液测定锥形瓶中一定体积的盐酸的物质的量浓度.下列操作将导致测定值高于实际值的是( )A、标准液在“0”刻度线以上,未予调整就开始滴定 B、滴定过程中振荡时,锥形瓶中有液滴溅出 C、观察记录滴定管内液面刻度时滴定前俯视,滴定后仰视 D、酚酞指示剂由无色变为红色时立即停止滴定