-
1、某废水处理过程中始终保持饱和,即 , 通过调节使和形成硫化物而分离,体系中与关系如图所示,为和的浓度,单位为 . 已知 , 下列说法正确的是( )
 A、 B、③为与的关系曲线 C、 D、
A、 B、③为与的关系曲线 C、 D、 -
2、时,在溶液中滴入溶液,含磷元素的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与的关系如图所示.下列说法不正确的是( )
 A、的数量级为 B、等物质的量和溶于水,其大于7.2 C、向溶液中加入足量的溶液,溶液碱性减弱 D、可依次选用甲基橙、酚酞作指示剂,标定反应终点
A、的数量级为 B、等物质的量和溶于水,其大于7.2 C、向溶液中加入足量的溶液,溶液碱性减弱 D、可依次选用甲基橙、酚酞作指示剂,标定反应终点 -
3、某温度下,在恒温密闭容器中投入 , 发生反应 , 有关说法正确的是( )
时间段/s
产物的平均生成速率
0.4
0.3
0.2
A、时,的浓度为 B、时,加入 , 此时 C、时,的转化率为 D、时,加入和 , 再次平衡时体系压强增大 -
4、已知 . 某温度下,在水中的沉淀溶解平衡曲线如图所示.下列说法不正确的是( )
 A、和两点的不同 B、 C、向饱和溶液中加入固体,可使点变到点 D、平衡常数
A、和两点的不同 B、 C、向饱和溶液中加入固体,可使点变到点 D、平衡常数 -
5、某实验小组利用溶液与溶液的反应研究外界条件对化学反应速率的影响.设计实验如下表:
实验编号
温度/
出现浑浊时间/s
①
10
5.0
10.0
0
②
10
5.0
5.0
③
50
5.0
10.0
0
下列说法不正确的是( )
A、实验②中 B、 C、研究温度的影响时,应将溶液混合后置于不同温度的水浴中 D、此实验小组探究了浓度和温度对化学反应速率的影响 -
6、乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成.图中的双极膜中间层中的解离为和 , 并在直流电场作用下分别向两极迁移.下列说法正确的是( )
 A、在上述电化学合成过程中只起电解质的作用 B、阳极上的反应式为: C、制得乙醛酸,理论上外电路中迁移了电子 D、双极膜中间层中的在外电场作用下向铅电极方向迁移
A、在上述电化学合成过程中只起电解质的作用 B、阳极上的反应式为: C、制得乙醛酸,理论上外电路中迁移了电子 D、双极膜中间层中的在外电场作用下向铅电极方向迁移 -
7、下列有关装置图的说法正确的是( )
 A、装置①中键闭合时,片刻后可观察到滤纸附近变红色 B、装置①中键闭合时,片刻后溶液中增大 C、装置②中铁腐蚀的速率由大到小的顺序是只闭合只闭合只闭合都断开 D、装置③中当铁制品上析出铜时,电源负极输出的电子数为
A、装置①中键闭合时,片刻后可观察到滤纸附近变红色 B、装置①中键闭合时,片刻后溶液中增大 C、装置②中铁腐蚀的速率由大到小的顺序是只闭合只闭合只闭合都断开 D、装置③中当铁制品上析出铜时,电源负极输出的电子数为 -
8、下列说法中正确的个数是( )
①从空间的角度看,轨道比轨道大,其空间包含了
②能级的轨道数依次增多
③区全部是金属元素
④电负性的大小可以用作判断元素非金属性强弱的依据
⑤第一电离能的大小可以作为判断金属性强弱的依据
⑥共价化合物中,电负性大的成键元素表现为负价
⑦电负性越大,元素的非金属性越强,第一电离能也越大
⑧第四周期元素中,未成对电子数最多的元素位于钾元素后面第五位
⑨电负性大于1.8的一定为非金属,小于1.8的一定为金属
A、3个 B、4个 C、5个 D、6个 -
9、下列实验操作、实验现象与解释或结论相对应的是( )
实验操作
实验现象
解释或结论
A
常温下,分别测量浓度均为和溶液的
溶液的值小于溶液
酸性:
B
相同条件下,分别测量和醋酸溶液的导电性
前者的灯泡更亮
醋酸的浓度越大,电离程度越大
C
向饱和硼酸溶液中加入少量粉末
无气泡冒出
酸性:碳酸>硼酸
D
向溶液滴加溶液,再向其中滴加溶液
先生成白色沉淀,后有黄色沉淀生成
A、A B、B C、C D、D -
10、一定温度下,反应在密闭容器中达到平衡时,测得 . 相同温度下,按下列4组初始浓度进行实验,下列说法不正确的是( )
①
②
③
④
0.40
0.20
0.20
0.20
1.00
0.40
0.20
0.50
0
0.40
0.20
0
A、平衡时的体积分数:①=② B、③中: C、④中反应达到平衡时,的转化率为 D、该温度下,③中反应的平衡常数 -
11、前四周期元素的原子序数依次增大.与是相邻周期的同主族元素,的单质可用于制作光感电池.基态原子的轨道上有2个未成对电子,原子的电子总数是其能级电子数的5倍.下列说法正确的是( )A、W元素基态原子具有5种不同能量的电子 B、元素基态原子具有价层电子排布式为: C、属于元素周期表中区元素 D、基态X电子的轨道表示式为

-
12、氯碱工业的一种节能新工艺是将电解池与燃料电池相结合,相关物料的传输与转化关系如图所示(电极未标出).下列说法不正确的是( )
 A、通入空气的电极为正极 B、电解池中产生时,理论上燃料电池中消耗 C、电解池的阴极反应式为 D、的大小关系为
A、通入空气的电极为正极 B、电解池中产生时,理论上燃料电池中消耗 C、电解池的阴极反应式为 D、的大小关系为 -
13、下列化学用语正确的是( )A、硫酸氢钠溶液的电离方程式: B、硫酸钡的溶解平衡: C、溶于中的水解平衡: D、氢氟酸的电离方程式:
-
14、常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、溶液: B、澄清透明溶液中: C、水电离出来的的溶液: D、溶液:
-
15、化学与生活、科技密切相关.下列说法正确的是( )A、盐碱地(含较多),可通过施加适量熟石灰来降低土壤得碱性 B、锅炉中的水垢主要成分是 , 可用稀盐酸直接处理除去 C、医疗上常用作X射线透视肠胃的内服药剂,俗称“钡餐” D、鲍鱼的外壳是呈棱柱状的方解石,内层是珠光层的霰石,两者成分相同,结构不同
-
16、我国“蛟龙”号载人潜水器最关键的部件——供人活动的耐压球壳是用钛合金制造的.是制备金属钛的重要中间体.某小组同学利用如下装置在实验室制备(夹持装置略去).

已知:易挥发,高温时能与反应,不与反应,易水解生成白色沉淀,熔点 , 沸点 .
回答下列问题:
(1)、A装置分液漏斗上方的胶皮管的作用是 .(2)、装置B中盛装的试剂为 , 装置B中长玻璃管的作用为 .(3)、装置C中除生成外,还生成一种气态不成盐氧化物,该反应的化学方程式为 .(4)、在通入前,先打开开关k,从侧管持续通入一段时间的气体的目的是 .(5)、装置E中盛装试剂为浓硫酸,其作用为 .(6)、为测定所得的纯度:取锥形瓶中所得产品加入烧杯中,再加入适量蒸馏水,待充分反应后,过滤,洗涤,所得固体经过焙烧得到固体 . 则产品的纯度为%.(已知) -
17、高铁酸钾是一种高效多功能的绿色消毒剂,某兴趣小组欲利用废铁屑(主要成分为 , 还含有少量和)制取高铁酸钾,其工艺流程图如下.

请回答下列问题:
(1)、“滤渣”的主要成分为 .(2)、“操作1”所需的玻璃仪器包括 .(3)、写出的电子式 .(4)、加入饱和溶液时发生反应 , 试解释该反应能发生的原因 .(5)、处理水时,不仅能杀菌消毒,还能形成(填化学式)吸附水中悬浮杂质而净化水.(6)、高铁酸钾在碱性条件下稳定,在中性潮湿环境中会产生红褐色的物质,并释放出一种能使带火星的木条复燃的气体.试写出高铁酸钾溶解在中性溶液中与水反应的离子方程式 .(7)、若生成的反应原理可表示为: , 当反应中转移电子总数为时,生成的物质的量为 . -
18、元素的单质及其化合物在生产、生活中均有重要用途.请结合相关知识回答下列问题:(1)、氯化钠是常见的调味品,也是重要的化工原料.向饱和氯化钠溶液中先后通入两种常见气体可以制备小苏打,写出后通入的气体的结构式 .(2)、“84”消毒液是一种常见的消毒剂,其有效成分为 .
①“84”消毒液不可与洁厕灵(主要成分浓盐酸)混合使用会产生一种有毒的气体,请用离子方程式表示该反应 .
②实验室要配制的溶液.所需的玻璃仪器有量筒,烧杯、玻璃棒、、 .
③配制过程中,下列操作会导致溶液浓度偏低的是 . (填字母序号)
A.称量固体
B.容量瓶使用时未干燥
C.定容时俯视刻度线
D.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④将通入冷的烧碱中可以得到和 , 温度较高时,还会有生成,若反应生成的与的物质的量之比为 , 试从电子守恒角度分析氧化剂与还原剂的物质的量之比为 .
(3)、是公认的高效安全灭菌消毒剂之一.①工业上可采用与氯酸钠在硫酸存在条件下反应制取 , 并生成一种酸式盐,写出工业上制取反应的化学方程式 .
②和都是利用强氧化性来杀菌消毒,的消毒能力是的2.5倍(以氧化剂生成稳定产物时得到的电子数来计算),则对应的稳定产物是 .
-
19、A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,它们的相关信息如表所示.
序号
相关信息
①
A的最外层电子数是次外层电子数的2倍
②
B的单质在空气中含量最大
③
C的简单氢化物常温下呈液态
④
D、E、F的最高价氧化物对应的水化物两两之间均可反应
⑤
F的最高正价与最低负价的代数和等于4
请回答下列问题:
(1)、A元素的一种核素可用于测定文物年代,该核素可表示为 . (用原子符号表示)(2)、简单气态氢化物的稳定性CB(填“>”“<”或“=”).(3)、C、E、G三种元素对应的简单离子半径由大到小的顺序为(用元素的离子符号表示).(4)、D、E的最高价氧化物对应的水化物相互反应的离子方程式为 .(5)、元素G与元素F相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是(填字母序号)A.含氧酸的酸性:
B.G的单质能与F的气态氢化物反应,置换出F的单质
C.单质与发生化合反应,生成物中的化合价:
D.单质的熔沸点:
(6)、两种化合物发生反应,该反应包含了离子键、极性键和非极性键的断裂与生成,且仅含A、C、D三种元素,完成该反应的化学方程式 . -
20、向溶液中逐渐通入一定量的(假设溶液体积不变),随后取此溶液 , 将其稀释至 , 并向此稀释后的溶液中逐滴加入的盐酸,产生气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
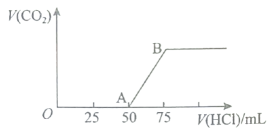 A、段所发生反应的离子方程式: B、在吸收后,所得溶液的溶质为和 , 其物质的量之比为 C、产生的的体积为(标准状况下) D、原溶液的物质的量浓度为
A、段所发生反应的离子方程式: B、在吸收后,所得溶液的溶质为和 , 其物质的量之比为 C、产生的的体积为(标准状况下) D、原溶液的物质的量浓度为