-
1、在下图烧杯中均盛有0.1mol/LNaCl溶液,其中铁片最易被腐蚀的是( )A、
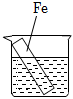 B、
B、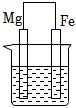 C、
C、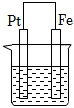 D、
D、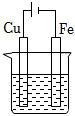
-
2、如图,甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。下列说法正确的是( )
 A、甲池通入CH3OH的电极反应式为CH3OH+6e﹣+2H2O=CO32﹣+8H+ B、甲池中消耗224mL(标准状况)O2 , 此时丙池中理论上产生1.16g固体 C、反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 D、若将乙池电解质溶液换成AgNO3溶液,则可以实现在石墨棒上镀银
A、甲池通入CH3OH的电极反应式为CH3OH+6e﹣+2H2O=CO32﹣+8H+ B、甲池中消耗224mL(标准状况)O2 , 此时丙池中理论上产生1.16g固体 C、反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 D、若将乙池电解质溶液换成AgNO3溶液,则可以实现在石墨棒上镀银 -
3、下列说法错误的是( )A、需要加热才能发生的反应一定是吸热反应 B、在热化学方程式中无论反应物还是生成物均必须标明聚集状态 C、焓变小于0而熵变大于0的反应肯定是自发的 D、轮船水线以下的船体上嵌入一定量的锌块可减缓海水对轮船的腐蚀
-
4、若要在铁片上镀银,下列叙述中错误的是( )
①将铁片接在电源的正极上
②将银片接在电源的正极上
③在铁片上发生的反应是:Ag++e﹣═Ag
④在银片上发生的反应是:4OH﹣﹣4e﹣═O2↑+2H2O
⑤需用硫酸铁溶液为电镀液
⑥需用硝酸银溶液为电镀液
A、①③⑥ B、②③⑥ C、①④⑤ D、②③④⑥ -
5、苯的亲电取代反应分两步进行,可表示
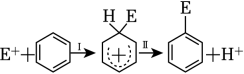 , 苯的亲电取代反应进程和能量的关系如图,下列说法错误的是( )
, 苯的亲电取代反应进程和能量的关系如图,下列说法错误的是( )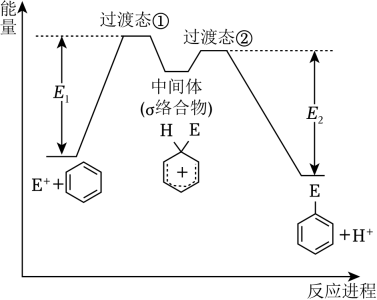 A、反应过程中,环上碳原子的杂化类型发生了变化 B、反应速率:Ⅰ<Ⅱ C、平均能量:中间体>反应物 D、E1与E2的差值为总反应的焓变
A、反应过程中,环上碳原子的杂化类型发生了变化 B、反应速率:Ⅰ<Ⅱ C、平均能量:中间体>反应物 D、E1与E2的差值为总反应的焓变 -
6、某小组为研究电化学原理,设计如图装置.下列叙述正确的是( )
 A、a和b用导线连接时,铁片上会有金属铜析出 B、a和b用导线连接时,铜片上发生的反应为:Cu2+﹣2e﹣=Cu C、无论a和b是否连接,铁片均会溶解 D、无论a和b是否连接,铁片上发生的反应都是:Fe﹣3e﹣=Fe3+
A、a和b用导线连接时,铁片上会有金属铜析出 B、a和b用导线连接时,铜片上发生的反应为:Cu2+﹣2e﹣=Cu C、无论a和b是否连接,铁片均会溶解 D、无论a和b是否连接,铁片上发生的反应都是:Fe﹣3e﹣=Fe3+ -
7、化学与社会、生活密切相关,下列说法正确的是( )A、氢氧化铝、碳酸钠常用作胃酸中和剂 B、水泥和沙子都属于建筑材料中的硅酸盐产品 C、胆矾可用于杀菌消毒,也可作食品防腐剂 D、治理雾霾的有效方法是从源头上控制形成雾霾的污染物
-
8、下列说法正确的是( )A、增大反应物浓度可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 B、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 C、升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 D、催化剂能增大单位体积内活化分子的百分数,使平衡转化率增大
-
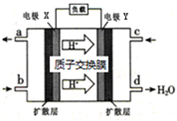
9、国家能源局发布2021年前三季度全国光伏发电建设运行情况,前三季度新增并网容量2555.6万千瓦,下列如图为光伏并网发电装置,甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],其工作原理如图所示,下列叙述中不正确的是( )
 A、光伏并网发电装置是利用原电池原理,图中N型半导体为负极,P型半导体为正极 B、a极电极反应式:2(CH3)4N++2H2O+2e﹣=2(CH3)4NOH+H2↑ C、制备18.2g(CH3)4NOH,两极共产生4.48L气体(标准状况) D、c、e为阳离子交换膜,d均为阴离子交换膜
A、光伏并网发电装置是利用原电池原理,图中N型半导体为负极,P型半导体为正极 B、a极电极反应式:2(CH3)4N++2H2O+2e﹣=2(CH3)4NOH+H2↑ C、制备18.2g(CH3)4NOH,两极共产生4.48L气体(标准状况) D、c、e为阳离子交换膜,d均为阴离子交换膜 -
10、绿色电源“二甲醚﹣氧气燃料电池”的工作原理如图,所示下列说法正确的是( )
 A、氧气应从c处通入,电极Y上发生的反应为O2+4e﹣+2H2O═4OH﹣ B、电池在放电过程中,电极X周围溶液的pH增大 C、二甲醚应从b处加入,电极X上发生的反应为(CH3)2O﹣12e﹣+3H2O=2CO2+12H+ D、当该电池向外电路提供2mol电子时消耗O2约为22.4L
A、氧气应从c处通入,电极Y上发生的反应为O2+4e﹣+2H2O═4OH﹣ B、电池在放电过程中,电极X周围溶液的pH增大 C、二甲醚应从b处加入,电极X上发生的反应为(CH3)2O﹣12e﹣+3H2O=2CO2+12H+ D、当该电池向外电路提供2mol电子时消耗O2约为22.4L -
11、下列说法不正确的是( )
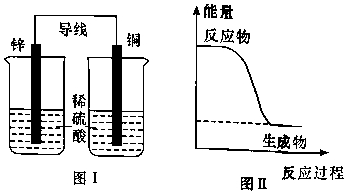 A、图Ⅰ所示装置不能形成原电池 B、铅蓄电池为二次电池,充电时,铅电极接外接电源的正极 C、燃料电池是一种将燃料和氧化剂的化学能直接转化为电能的装置 D、反应NH3(g)+HCl(g)═NH4Cl(s)的能量变化如图Ⅱ所示,则该反应在低温下能自发进行
A、图Ⅰ所示装置不能形成原电池 B、铅蓄电池为二次电池,充电时,铅电极接外接电源的正极 C、燃料电池是一种将燃料和氧化剂的化学能直接转化为电能的装置 D、反应NH3(g)+HCl(g)═NH4Cl(s)的能量变化如图Ⅱ所示,则该反应在低温下能自发进行 -
12、硫酸甲酯(CH3OSO3H)是制造染料的甲基化试剂,在有H2O存在的条件下,CH3OH和SO3的反应历程如图所示(分子间的作用力用“…”表示)。下列说法错误的是( )
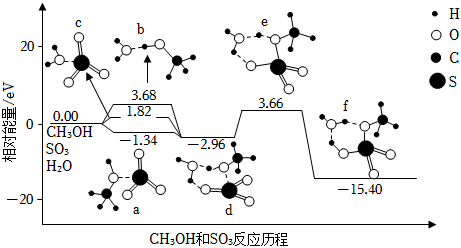 A、CH3OH与SO3反应的△H<0 B、a、b、c三种中间产物中,a最稳定 C、该反应最高能垒(活化能)为19.06eV D、由d转化为f过程中,有硫氧键的断裂和生成
A、CH3OH与SO3反应的△H<0 B、a、b、c三种中间产物中,a最稳定 C、该反应最高能垒(活化能)为19.06eV D、由d转化为f过程中,有硫氧键的断裂和生成 -
13、利用浓差电池制备高铁电池的重要材料Na2FeO4 , 反应原理如图所示。下列说法错误的是( )
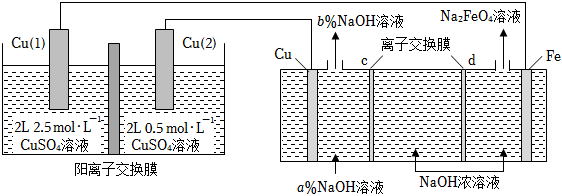 A、a<b B、c为阳离子交换膜,当Cu电极产生1mol气体时,有2molNa+通过阳离子交换膜 C、浓差电池放电过程中,Cu(Ⅰ)电极上的电极反应为Cu﹣2e﹣=Cu2+ D、Fe电极的电极反应为:Fe+8OH﹣﹣6e﹣═FeO42﹣+4H2O
A、a<b B、c为阳离子交换膜,当Cu电极产生1mol气体时,有2molNa+通过阳离子交换膜 C、浓差电池放电过程中,Cu(Ⅰ)电极上的电极反应为Cu﹣2e﹣=Cu2+ D、Fe电极的电极反应为:Fe+8OH﹣﹣6e﹣═FeO42﹣+4H2O -
14、已知有以下物质相互转化:

试回答下列问题:
(1)、写出B的化学式: , D的化学式:。(2)、写出由E转变成F的化学方程式:。(3)、写出用KSCN鉴别G溶液的离子方程式:。向G溶液中加入A的有关反应的离子方程式:。 -
15、X、Y、Z、M、Q、R皆为周期表中前20号元素,其原子半径与主要化合价的关系如图所示。
 (1)、已知X位于第一周期,则X2Y电子式为。(2)、比较Y和Z的简单氢化物,更稳定的是(填化学式)。(3)、已知Q位于第三周期,则R在元素周期表中的位置是。(4)、下列推断正确的是。
(1)、已知X位于第一周期,则X2Y电子式为。(2)、比较Y和Z的简单氢化物,更稳定的是(填化学式)。(3)、已知Q位于第三周期,则R在元素周期表中的位置是。(4)、下列推断正确的是。a.简单离子半径:M->Q+>R2+
b.由X、Y、Z三种元素组成的化合物可能是盐或碱
c.Z与M的最高价氧化物对应水化物均为强酸
(5)、M的单质通入淀粉-KI溶液,溶液变蓝,写出该反应的离子方程式 , 比较I-和M的阴离子,还原性更强的是(填离子符号),从原子结构的角度解释原因。 -
16、“84消毒液”主要成分为次氯酸钠溶液,它是疫情阶段最常见的消毒剂之一,它可由氯气和氢氧化钠溶液反应后制得。为制备氯气并探究氯气的性质,某同学设计了如下所示的实验装置。

请回答:
(1)、实验室制取氯气的化学方程式为 , 用该反应制取氯气选用的发生装置是(填字母)。 (2)、装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,观察到装置C中的湿润布条褪色,涉及到的化学反应的离子方程式为;实验过程中该同学还发现装置B中的布条也褪色,使实验结果不准确,为保证实验结果的准确性,在AB之间加装一个洗气瓶,洗气瓶中加入的试剂为。(3)、写出F中氯气与NaOH溶液反应的化学方程式。(4)、为验证装置F中吸收完氯气的溶液中存在Cl- , 正确的操作是:取少量待测液体于试管中,加入足量稀硝酸酸化,再向其中加入 , 若观察到 , 则证明溶液中存在Cl- , 该反应的离子方程式为。
(2)、装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,观察到装置C中的湿润布条褪色,涉及到的化学反应的离子方程式为;实验过程中该同学还发现装置B中的布条也褪色,使实验结果不准确,为保证实验结果的准确性,在AB之间加装一个洗气瓶,洗气瓶中加入的试剂为。(3)、写出F中氯气与NaOH溶液反应的化学方程式。(4)、为验证装置F中吸收完氯气的溶液中存在Cl- , 正确的操作是:取少量待测液体于试管中,加入足量稀硝酸酸化,再向其中加入 , 若观察到 , 则证明溶液中存在Cl- , 该反应的离子方程式为。 -
17、现有下列七种物质:①CO2 ②过氧化钠 ③氧化铁 ④0.5mol/LNaOH溶液 ⑤碳酸氢钠 ⑥0.5mol/LNaHSO4溶液 ⑦次氯酸钠。请根据上述物质回答下列问题:(1)、在上述物质中属于电解质的有(填①~⑦序号)(2)、含有0.4mol氧原子的②与足量①反应,产生气体在标准状况下的体积为L。(3)、写出③物质的一种用途。(4)、某同学帮助水质检测站配制240mL④溶液以备使用。
①该同学应用托盘天平称取NaOH固体g。
②配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、。
③定容时仰视刻度线,则所配制的溶液的浓度会(填“偏高”、“偏低”、“不变”)。
(5)、⑤⑥两种溶液混合可以发生反应,离子方程式为。(6)、废水脱氨工艺有一种方法是在废水中加入过量⑦使完全转化为N2 , 此方法可用离子方程式表示为:2+3ClO-=N2↑+3Cl-+2H++3H2O。用单线桥法在离子方程式上标出电子转移的方向和数目;该反应中氧化剂与还原剂的物质的量之比为。 -
18、当溶液中与离子个数比为5:2时,溶液中离子中X元素恰好被氧化为较高价态,同时生成Mn2+ , 则反应后X元素的化合价为( )A、+1 B、+2 C、+3 D、+4
-
19、有A、B、C、D、E五种元素,质子数都小于18。B原子的最外层电子数是其电子层数的3倍;C原子失去1个电子所得到的微粒具有与氖原子相同的电子层结构;D是地壳中含量最多的金属元素;E的最高正价与最低负价的代数和为6;A单质可以在E单质中燃烧,生成AE,燃烧时火焰呈苍白色。下列说法错误的是( )A、A2B中只含极性共价键 B、B和C两种元素形成的化合物一定含有离子键也可能含有共价键 C、E单质可以使干燥的红色布条褪色 D、D单质常温下既能溶于稀盐酸也能溶于氢氧化钠溶液
-
20、在FeCl3和CuCl2的混合溶液中加入铁粉,充分反应后有固体剩余,经过滤后滤液中的可能含有的离子有:①Fe2+ ②Fe2+和Fe3+ ③Fe2+和Cu2+ ④Fe3+和Cu2+( )A、①③ B、②④ C、①④ D、②③