-
1、下列装置或操作能达到实验目的的是( )
选项
A
B
C
D
实验装置或操作
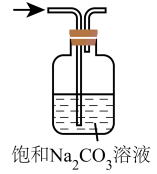
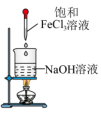

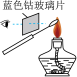
实验目的
除去CO2中的HCl
制备Fe(OH)3胶体
蒸发NaCl溶液
检验某溶液中是否含有钾元素
A、A B、B C、C D、D -
2、下列解释相应变化的离子方程式书写错误的是( )
选项
相应变化
离子方程式
A
碳酸钠溶液中滴加过量盐酸
CO32-+ 2H+= CO2↑+ H2O
B
用FeCl3溶液腐蚀覆铜板制作电路板
2Fe3++ Cu = 2Fe2++ Cu2+
C
向氢氧化钡溶液中滴入硫酸至混合溶液的导电能力降到最低点
Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O
D
氯气溶于水呈酸性
Cl2+ H2O= 2H++ Cl-+ ClO-
A、A B、B C、C D、D -
3、N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂。下述反应能产生N2O:3CO+ 2NO2= 3CO2+ N2O。下列关于该反应的说法正确的是( )A、CO发生还原反应 B、氧化剂和还原剂的比为3:2 C、NO2被还原 D、0.2mol NO2参加反应转移电子数为0.3 mol
-
4、物质间的转化是认识化学的重要途径,下列物质之间的转化不能通过一步实现的是( )A、Na→ Na2O2 B、Na→ Na2CO3 C、Na→ NaOH D、Na→ NaCl
-
5、在澄清透明的酸性溶液中,下列离子能共存的是( )A、Fe3+、SO42-、Na+、NO3- B、K+、MnO4-、Fe2+、SO42- C、Cu2+、OH-、Mg2+、SO42- D、Ba2+、OH-、Cl-、SO42-
-
6、五育并举,劳动先行。下列劳动项目与所述的化学知识没有关联的是( )
选项
劳动项目
化学知识
A
帮厨活动:用适量食醋除去锅炉铁锈
醋酸可与铁锈反应生成可溶物
B
环保行动:将废弃电池送到专门回收点
废旧电池含有重金属离子等,处理不当会污染环境
C
家务劳动:用洁厕灵(主要成分是盐酸)清洗马桶
利用洁厕灵的强氧化性杀菌消毒
D
学农活动:用厨余垃圾制农家肥
厨余垃圾含N、P、K等元素
A、A B、B C、C D、D -
7、化学与生活、生产及科技密切相关,下列说法错误的是( )A、“C919”国产大飞机实现商飞,其中使用的铝锂合金具有硬度大,质量轻等优点 B、新版人民币票面文字处的黑色油墨主要成分为Fe2O3 C、水是生命之源,自来水常用二氧化氯(ClO2)进行杀菌消毒 D、2023年杭州亚运会游泳馆采用次氯酸钠进行杀菌消毒,次氯酸钠具有强氧化性
-
8、中国传统文化对人类文明贡献巨大,其中也蕴含诸多的化学知识。以下说法正确的是( )A、“熬胆矾铁釜,久之亦化为铜”,该过程发生了复分解反应 B、四千余年前杜康用谷物酿造出酒,酿酒过程中只发生物理变化 C、“火树银花合,星桥铁锁开”,“火树银花”涉及的焰色试验是化学变化 D、“春蚕到死丝方尽,蜡炬成灰泪始干”诗句中涉及到氧元素的化合价变化
-
9、我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3nm)恢复了磁性,下列关于“钴酞菁”分子的说法正确的是 ( )A、其在水中形成的分散系属于溶液 B、其在水中形成的分散系能产生丁达尔效应 C、“钴酞菁”分子直径比K+的直径小 D、“钴酞菁”分子能透过半透膜
-
10、“挖掘文物价值,讲好中国故事”。下列文物主要由金属材料制成的是( )
选项
A
B
C
D
文物




东汉铜车马
北宋王希孟
千里江山图
萧何月下追韩信梅瓶
南海I号印花陶罐
A、A B、B C、C D、D -
11、我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。在实际生产中,可利用反应CO2+ 2NaOH= Na2CO3+ H2O或CO2+ NaOH= NaHCO3来捕捉废气中的CO2 , 下列有关化学用语或说法正确的是( )A、Na的结构示意图:
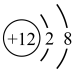 B、NaHCO3俗称小苏打
C、中子数为8的氧原子:
D、NaHCO3的电离方程式:NaHCO3= Na++ H++ CO32-
B、NaHCO3俗称小苏打
C、中子数为8的氧原子:
D、NaHCO3的电离方程式:NaHCO3= Na++ H++ CO32-
-
12、某兴趣小组对无机盐X (仅含三种短周期元素)开展探究实验。
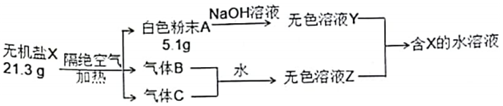
其中:A、B、C均为纯净物,白色粉末A难溶于水,B为红棕色气体。生成的B和C气体恰好与水完全反应(无气体剩余)生成溶液Z。请回答:
(1)、组成X的3种元素是 (填元素符号),X的化学式是 。(2)、写出X隔绝空气加热分解的化学方程式是 。(3)、写出溶液Y和溶液Z反应生成X的离子方程式是 。(4)、某同学探究B与Na2O2的反应,提出2种假设:①B氧化Na2O2 , 反应生成一种盐和一种气体单质
②Na2O2氧化B,反应只生成一种盐。
请设计实验证明 。
-
13、氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
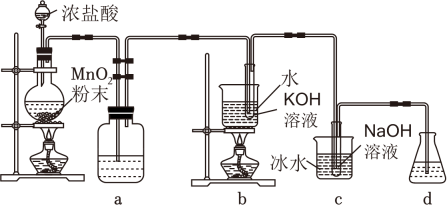
请回答下列问题:
(1)、盛放浓盐酸的仪器名称是 , a的作用为 。若一共有4.48L(标准状况)Cl2生成,反应中转移电子的数目为 。(2)、b中采用的加热方式的优点为 , b中反应的化学方程式为 。(3)、c中采用冰水浴冷却的目的是 。(4)、反应结束后,取出b中试管,经冷却结晶, , 洗涤,干燥,得到KClO3晶体。(5)、取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管KClO3溶液颜色不变;2号试管NaClO溶液变为棕色,加入CCl4振荡,静置后CCl4层显 色。可知该条件下NaClO的氧化能力 KClO3(填“大于”或“小于”)。 -
14、环己酮(
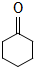 )是重要的化工原料。实验室氧化环己醇制备环己酮的流程如图:
)是重要的化工原料。实验室氧化环己醇制备环己酮的流程如图: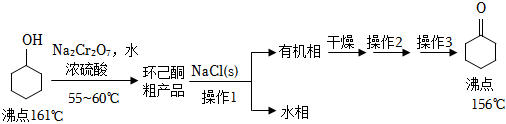
回答下列问题:
(1)、Ⅰ.环己酮粗品的制备
对环己醇氧化前的正确操作顺序是 (填写序号)。①加入药品
②检验装置气密性
③连接仪器
(2)、有机实验一般不使用酒精灯加热,而是使用电热套进行加热,原因是 。硫酸浓度较大或温度过高时都会产生的烃类副产物是 。为了防止水分和产物的大量挥发,需采取的措施除控制加热温度外,还可以加装的仪器名称是 。(3)、薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别将反应不同时间后的溶在反应开始、回流15min、30min、45min和60min时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。
该实验条件下较合适的反应时间是 min。反应结束后,溶液中仍有过量的重铬酸盐,可加入适量草酸除去,该反应的氧化产物为 。
(4)、Ⅱ.环己酮粗品的精制操作1用到的最佳玻璃仪器有 (选填下列仪器序号)。水相用乙醚分两次萃取,萃取液与有机相合并,这样做的目的是 。
 (5)、无水硫酸钠粉末干燥有机相后,形成Na2SO4•xH2O晶块,操作2、操作3依次是 、。(6)、本次实验恢复室温,0.050mol环己醇原料最终得到4.0mL纯品(密度为0.95g•cm﹣3),则环己酮的产率为 (保留3位有效数字)。
(5)、无水硫酸钠粉末干燥有机相后,形成Na2SO4•xH2O晶块,操作2、操作3依次是 、。(6)、本次实验恢复室温,0.050mol环己醇原料最终得到4.0mL纯品(密度为0.95g•cm﹣3),则环己酮的产率为 (保留3位有效数字)。 -
15、电池种类丰富,发展飞速,应用广泛,为我们的生产和生活带来了非常大的便利。(1)、某兴趣小组设计了如图所示的原电池装置,该电池的负极为 , 正极的电极反应式为 , 盐桥中装有含氯化钾的琼脂,其中K+移向溶液 [填“Fe2(SO4)3”或“CuSO4”]。
 (2)、装置中所用到的硫酸铜是一种常用试剂,该小组尝试用以下两种方案制备硫酸铜。
(2)、装置中所用到的硫酸铜是一种常用试剂,该小组尝试用以下两种方案制备硫酸铜。方案一:直接用铜和浓硫酸制备硫酸铜;
方案二:将铜和银同时浸泡在稀硫酸中,不断通入氧气,一段时间后可以获得硫酸铜。
①写出方案一的化学方程式;与方案二相比,该方案的不足之处是 、(至少写出2种)。
②写出方案二的电极反应式:正极:、负极:。
(3)、甲醇是重要的化工原料,又可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:
电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是 (填“正极”或“负极”),c电极的电极反应式为 ;若线路中转移3mol电子,则上述CH3OH燃料电池,消耗的CH3OH的质量为 g。
(4)、某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法正确的是 ____(单项选择)。 A、放电时,正极的电极反应式为Fe2O3+6Li++6e﹣═2Fe+3Li2O B、该电池可以用水溶液做电解质溶液 C、放电时,Fe作电池的负极,Fe2O3作电池的正极 D、充电完成后,电池被磁铁吸引
A、放电时,正极的电极反应式为Fe2O3+6Li++6e﹣═2Fe+3Li2O B、该电池可以用水溶液做电解质溶液 C、放电时,Fe作电池的负极,Fe2O3作电池的正极 D、充电完成后,电池被磁铁吸引 -
16、熔融状态下,Na和FeCl2能组成可充电电池(装置如图所示),反应原理为:2Na+FeCl2Fe+2NaCl下列关于该电池的说法正确的是( )
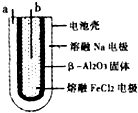 A、放电时,a为正极,b为负极 B、放电时,负极反应为:Fe2++2e﹣=Fe C、充电时,a接外电源正极 D、充电时,b极处发生氧化反应
A、放电时,a为正极,b为负极 B、放电时,负极反应为:Fe2++2e﹣=Fe C、充电时,a接外电源正极 D、充电时,b极处发生氧化反应 -
17、乙醛酸(OHCCOOH)是合成名贵高档香料乙基香兰素的原料之一,可用草酸(HOOCCOOH)电解制备,装置如图所示.下列说法不正确的是( )
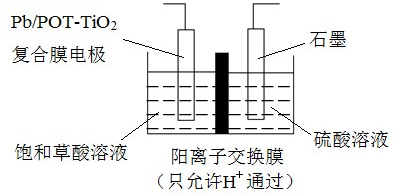 A、电解时石墨电极应与直流电源的正极相连 B、阴极反应式为:HOOCCOOH+2H++2e﹣═OHCCOOH+H2O C、电解时石墨电极上有O2放出 D、电解一段时间后,硫酸溶液的pH不变化
A、电解时石墨电极应与直流电源的正极相连 B、阴极反应式为:HOOCCOOH+2H++2e﹣═OHCCOOH+H2O C、电解时石墨电极上有O2放出 D、电解一段时间后,硫酸溶液的pH不变化 -
18、下列说法中正确的是( )A、钡中毒患者可尽快使用苏打溶液洗胃,随即导泻使Ba2+转化为BaCO3而排出 B、珊瑚虫从周围海水中获取Ca2+和HCO3﹣ , 经反应形成石灰石(CaCO3)外壳,逐渐形成珊瑚 C、水中的Mg(HCO3)2、Ca(HCO3)2 , 受热易分解生成难溶性的MgCO3、CaCO3 , 故水垢的主要成分是MgCO3、CaCO3 D、使用含氟牙膏预防龋齿利用了盐类水解的原理
-
19、可逆反应N2+3H2⇌2NH3(各物质均为气体)的正、逆反应速率可用单位时间内各反应物或生成物浓度的变化来表示.下列各关系中能说明该反应已达到平衡状态的是( )A、3v正(N2)=v正(H2) B、v正(N2)=v逆(NH3) C、2 v正(H2)=3 v逆(NH3) D、2v逆(NH3)=3 v正(H2)
-
20、铅酸电池是一种可充电电池,其放电时的总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O。如图所示,利用铅酸电池电解Na2SO4溶液(a、b均为石墨电极),可以制得H2、O2、较浓的H2SO4和NaOH溶液。下列说法正确的是( )
 A、铝酸电池放电一段时间后,正、负极的质量均增加 B、N和M溶液分别为稀H2SO4和稀NaOH溶液 C、a电极的电极反应式为2H2O﹣4e﹣═O2↑+4H+ D、当电路中有1mol电子通过时,b电极收集到的O2体积为5.6L
A、铝酸电池放电一段时间后,正、负极的质量均增加 B、N和M溶液分别为稀H2SO4和稀NaOH溶液 C、a电极的电极反应式为2H2O﹣4e﹣═O2↑+4H+ D、当电路中有1mol电子通过时,b电极收集到的O2体积为5.6L