-
1、我国南北朝梁代陶弘景在其《本草经集注》条目的“灌钢法”中,记载我国古代冶炼钢铁的方法,将生铁(含碳量约2%)和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再锻打成钢。下列说法正确的是( )A、生铁的熔点比纯铁高 B、在我国使用最早的合金是生铁 C、“灌钢法”冶炼制得钢过程中提高了生铁中的含碳量 D、钢的硬度比铁大的原因是钢含碳原子,使铁原子层之间的相对滑动变得困难
-
2、在无色溶液中能大量共存的一组离子是( )A、 B、 C、 D、
-
3、劳动创造美好的生活。下列劳动项目与所述的化学知识没有关联的是( )
选项
劳动项目
化学知识
A
环保工程师用熟石灰处理酸性废水
熟石灰具有碱性
B
技术人员开发高端耐腐蚀镀铝钢板
铝能形成致密氧化膜
C
面包师用小苏打作发泡剂烘焙面包
可与酸反应
D
工人将模具干燥后再注入熔融钢水
在高温下铁与会反应
A、A B、B C、C D、D -
4、配制溶液,部分实验操作如图所示:

下列说法不正确的是( )
A、实验中用到的玻璃仪器有量筒、容量瓶、烧杯、玻璃棒、胶头滴管等 B、容量瓶用蒸馏水洗涤后无需干燥可使用 C、上述实验操作步骤的正确顺序为②①④①③ D、定容时,仰视容量瓶的刻度线,使配得的溶液浓度偏高 -
5、嫦娥五号返回舱带回的月壤中含有大量的 , 是清洁、安全的核聚变发电的燃料,地球上氦元素主要以的形式存在。下列说法正确的是( )A、的核外电子数为3 B、和互为同位素 C、的化学性质很活泼 D、发生核聚变时吸收大量热量
-
6、下列物质中,含共价键的离子化合物是( )A、 B、 C、 D、
-
7、化学处处呈现美。下列描述涉及的化学知识不正确的是( )A、茉莉花的芳香扑鼻而来,体现了分子是运动的 B、晨雾中的光束如梦如幻,是丁达尔效应带来的美景 C、甲烷分子为正四面体结构,四个氢原子完美对称 D、烟花燃放时呈现出五彩缤纷的火花,是锂、钠、铜等金属被氧化所致
-
8、分类是认识元素及其化合物的方法之一。下列有关物质分类的说法,正确的是( )A、纯净物:漂白粉、氯化铁 B、电解质:碳酸钠、食盐水 C、碱性氧化物:氧化铁、氧化钠 D、强酸:次氯酸、硫酸
-
9、化学与生产、生活密切相关。下列物质的应用中,涉及到氧化还原反应的是( )A、用醋酸除去水垢(主要成分) B、含消毒剂用于自来水杀菌消毒 C、用盐酸去除铁锈(主要成分) D、用生石灰作某些包装食品的干燥剂
-
10、近年我国在科技领域取得了举世瞩目的成就,下列成就所涉及的化学知识正确的是( )A、北斗三号卫星搭载了精密计时的铷原子钟,铷是金属元素 B、长征系列火箭所用的然料中,为氧化性气体 C、深海一号开采深海的天然气可作清洁燃料,实现零碳排放 D、火星全球影像彩图显示了火星表土颜色,表土中赤铁矿主要成分为
-
11、我国古代文物蕴含着瑰丽的中华历史文化,下列文物主要成分属于合金的是( )




A.兰亭集序书法
B.马王堆素纱禅衣
C.三星堆青铜面具
D.唐兽首玛瑙杯
A、A B、B C、C D、D -
12、人体每天通过食物和代谢产生酸性或碱性物质,但是人体却能维持一定的酸碱平衡,这是因为人体的肺、血液缓冲系统、肾彼此合作,共同完成酸碱平衡,当酸碱失衡时,会干扰代谢活动,严重时危及生命。表1为正常人血气分析部分结果,回答下列问题:
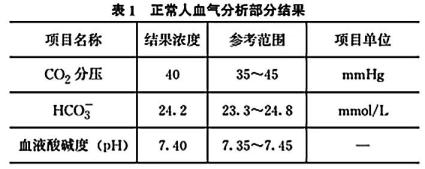 (1)、人体血液呈弱碱性的原因是(用离子方程式表示)。(2)、从平衡角度解释人体血液pH稳定的原因。(3)、当人体代谢性酸中毒严重时,需要血液透析治疗。
(1)、人体血液呈弱碱性的原因是(用离子方程式表示)。(2)、从平衡角度解释人体血液pH稳定的原因。(3)、当人体代谢性酸中毒严重时,需要血液透析治疗。① 预测“酸中毒”时表1“结果浓度”有可能会有哪些变化:。
② 配制某浓缩透析液需要用到的溶质有:0.7mol/LNaCl,0.01mol/LKCl,0.075mol/LCaCl2和0.15mol/LNaHCO3 , 直接混合各溶质会有沉淀(填化学式)和气体(填化学式)生成。
③ 医院透析液分两瓶存放,使用时稀释再混合。其中一瓶为NaHCO3 , 下列说法正确的是。
A. c(Na+)>c(HCO3-)>c(H+)>c(OH-)
B. c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)
C. c(CO32-)>c(H2CO3)
D. c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)
(4)、常温下,反应CaCO3(s)+2F-(aq)CaF2(s) +CO32-(aq)的平衡常数K=。[Ksp(CaCO3)=3.4×10-9 , Ksp(CaF2)=4×10-11] -
13、氢能将在实现“双碳”目标中起到重要作用。回答下列问题:(1)、乙醇水蒸气重整制氢反应是将乙醇与水按比例混合,最终转化为H2以及CO2的过程。发生的反应有:
I.C2H5OH(g)+H2O(g)2CO(g)+4H2(g)ΔH1=+255.7 kJ·mol-1
II.CO(g)+H2O(g) CO2(g)+H2(g)ΔH2=-41.2 kJ·mol-1
III.C2H5OH(g)+3H2O(g)2CO2(g)+6H2(g)ΔH3

① ΔH3= kJ·mol-1
② 在恒容反应炉内测得平衡时,乙醇转化率、H2产率和含碳产物体积分数与反应温度的关系如图所示,则最佳反应温度是 , 理由是。
③下列能判断反应I在恒容条件下达到平衡状态的是 。

A.混合气体的平均摩尔质量不变
B.单位时间内断开2molO-H键同时断开4molH-H
C.体系的压强不变
D.CO与H2的体积比不变
(2)、压强为100kPa下,C2H5OH(g)和H2O (g)投料比1∶3发生上述反应,平衡时CO2和CO的选择性、乙醇的转化率随温
度的变化曲线如图所示[已知:CO的选择性]
① 表示C2H5OH转化率的曲线是(填标号);
② 573K时,只考虑反应I和反应III,生成氢气的体积分数为(保留2位有效数字);
(3)、乙醇水蒸气重整制氢反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表
则催化剂X(填“优于”或“劣于”)催化剂Y,理由是。
-
14、废旧锌锰电池回收处理可实现资源的再利用,初步处理后的废料中含有MnO2、MnOOH、Zn(OH)2、及Fe等,用该废料制备Zn和MnO2的一种工艺流程如下:
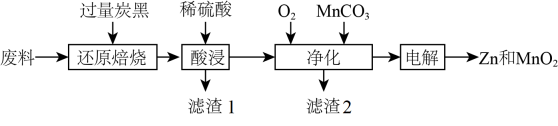
资料a:Mn的金属活动性强于Fe;
Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b:生成氢氧化物沉淀的pHMn(OH)2
Zn(OH)2
Fe(OH)3
开始沉淀时
8.1
6.2
1.9
完全沉淀时
10.1
8.2
3.2
回答下列问题:
(1)、“还原焙烧”是为了把Mn元素转化为MnO,请写出MnOOH发生反应的化学方程式。(2)、为了提高“酸浸”的速率,可以采取的措施有;滤渣1的主要成分为。(3)、 “净化”时通入O2的目的是 , 加入MnCO3时必须控制pH范围为;检验净化后的溶液中是否含有Fe元素的试剂是。(4)、 “电解”时MnO2在(填“阳”或“阴”)极生成,其电极反应式为 。 -
15、H2O2是一种常用的绿色氧化试剂,在化学研究中应用广泛。以下是某研究小组探究影响(H2O2溶液分解)反应速率部分因素的相关实验数据。
实验
序号
30%H2O2溶
液体积/mLH2O溶液体积/mL
温度℃
0.2mol/LFeCl3溶液/mL
收集氧气的体积/mL
反应所需
的时间/s①
3
2
20
2
10
175.65
②
5
0
20
2
10
138.32
③
5
0
35
2
10
89.71
④
5
0
55
2
10
30.96
(1)、通过实验①和②对比可知,;从实验(填实验序号)对比可知,温度越高,反应的速率越快。(2)、实验过程中还发现实验②中的现象为:刚开始时,溶液迅速变红棕色 , 并有较多气泡产生;一段时间后,反应变缓,溶液颜色明显变浅;溶液颜色变深的原因是。(3)、已知FeCl3溶液对H2O2的催化分解分为反应i和反应ii两步进行:已知反应ii的离子方程式为:2Fe2++ 2H++ H2O2= 2Fe3++ 2H2O;① 反应i离子方程式为。
② 某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴溶液,产生蓝色沉淀。
③ 另有同学用pH传感器测得的pH-时间图像中各段pH变化如图,加入FeCl3时pH值骤降至a点,是因为配制、保存FeCl3时需加入(填名称)抑制其水解。由图像pH值的变化可证明反应分两步进行,且反应速率反应i(填“>”、“=”或“<”)反应ii。

-
16、25℃时,满足c(CH3COOH)+ c(CH3COO-)=0.1mol/L的醋酸和醋酸钠混合溶液中,c(CH3COOH)与pH的关系如图所示。下列叙述错误的是( )
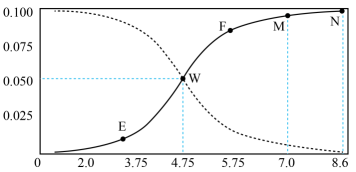 A、该温度下醋酸的电离常数Ka为10-4.75mol/L B、E点所表示的溶液中:c(CH3COO-)>c(Na+)> c(H+)>c(OH-) C、在图中各点中N点水的电离程度最大 D、F点所表示的溶液中:c(Na+)+c(H+)+c(CH3COOH)=0.1 mol/L
A、该温度下醋酸的电离常数Ka为10-4.75mol/L B、E点所表示的溶液中:c(CH3COO-)>c(Na+)> c(H+)>c(OH-) C、在图中各点中N点水的电离程度最大 D、F点所表示的溶液中:c(Na+)+c(H+)+c(CH3COOH)=0.1 mol/L -
17、长征系列运载火箭是中国自行研制的航天运载工具,偏二甲肼(C2H8N2)是提供动力的燃料之一,发生的反应为:C2H8N2+2N2O4=3N2+2CO2+4H2O。下列说法错误的是( )A、N2的电子式: B、1mol N2和H2O(g)混合物中含有的化学键数目为3NA C、标准状况下,生成22.4L CO2时转移的电子数为8NA D、46gN2O4中含有的电子数为23NA
-
18、某钠离子电池的负极材料为NaxCy , 正极材料为Na2Mn[Fe(CN)6],其充放电过程是Na+在正负极间的镶嵌与脱嵌(图中箭头指示电子的转移方向)。下列说法正确的是( )
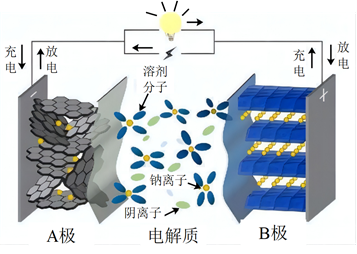 A、放电时,电子的流向为A→外电路→B→电解质溶液→A B、该电池可以选择NaOH溶液为电解质 C、充电时,Na+从B极脱嵌,在A极嵌入 D、放电时,B极的电极反应式为:NaxCy- xe-═ xNa++ Cy
A、放电时,电子的流向为A→外电路→B→电解质溶液→A B、该电池可以选择NaOH溶液为电解质 C、充电时,Na+从B极脱嵌,在A极嵌入 D、放电时,B极的电极反应式为:NaxCy- xe-═ xNa++ Cy -
19、一种用于季节性过敏性鼻炎的抗组胺药,合成原料之一的分子结构简式如图所示,关于该化合物说法正确的是( )
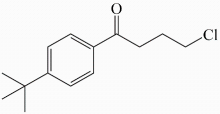 A、该化合物能发生加成反应、取代反应 B、属于醇类物质 C、该化合物有三种官能团 D、该化合物的分子式为C11H13OCl
A、该化合物能发生加成反应、取代反应 B、属于醇类物质 C、该化合物有三种官能团 D、该化合物的分子式为C11H13OCl -
20、 我国科学家在月球上发现一种硅酸盐矿物 , 该物质含有X、Y、Z、W、E五种主族元素,原子序数依次增大且均不大于20,X、W为非金属元素,Y、Z、E为金属元素,Y的最高正化合价为+1价,Z和E同族。下列说法正确的是( )A、原子半径:E>Y>Z>X>W B、X和Y可形成共价化合物 C、最高价氧化物对应的水化物的碱性: Z < E D、简单气态氢化物稳定性:W>X