-
1、化学在生产中有广泛的应用.下列说法正确的是( )A、电解冶炼镁、铝通常电解和溶液 B、电解精炼铜时,阳极减少的质量和阴极增加的质量相等 C、电镀银时电解质溶液中保持不变 D、用外加电流法对钢铁进行防护时,钢铁应连接电源的正极
-
2、下列有关滴定实验说法正确的是( )




A.锥形瓶使用前需用待测液醋酸润洗
B.可用该滴定管量取一定体积的溶液
C.碱式滴定管滴定前要排气泡
D.滴定前后滴定管读数方式如图所示,则测得的结果偏大
A、A B、B C、C D、D -
3、化学与社会、生活密切相关.下列生活现象与所述的化学知识没有关联的是( )
选项
生活现象
化学知识
小苏打作发酵剂
受热易分解
纯碱溶液不能保存在玻璃塞的试剂瓶中
高温下与反应
溶液可作焊接时的除锈剂
溶液呈酸性,能溶解铁锈
长期施用 , 土壤酸性增强
水解显酸性
A、A B、B C、C D、D -
4、一块铆有铁铆钉的铜板暴露在潮湿空气中的示意图如图,下列说法正确的是( )
 A、铜板表面有气泡生成 B、在干燥空气中该铜板也容易腐蚀 C、铁铆钉表面的电极反应: D、一段时间后,向水膜滴加一滴酚酞溶液,出现浅红色
A、铜板表面有气泡生成 B、在干燥空气中该铜板也容易腐蚀 C、铁铆钉表面的电极反应: D、一段时间后,向水膜滴加一滴酚酞溶液,出现浅红色 -
5、某小组同学查到一份研究过氧化氢溶液与氢碘酸反应的实验资料,具体如下.
资料1:室温下,过氧化氢溶液可与氢碘酸反应;
资料2:碘单质溶于水后,溶液为棕黄色.
资料3:实验数据见下表.
实验编号
溶液
溶液
蒸馏水
温度/
浓度
体积
浓度
体积
体积
Ⅰ
0.1
1
0.1
1
8
25
Ⅱ
0.1
1
0.1
1
40
Ⅲ
0.1
1
0.1
6
25
下列说法正确的是( )
A、 B、实验原理为 C、若将实验Ⅱ温度调整为 , 溶液出现棕黄色的时间更短 D、对比上述实验数据,推测反应速率最快的是实验Ⅲ -
6、分解的能量变化曲线如图所示.下列有关判断不正确的是( )
 A、该反应为吸热反应 B、过程Ⅰ使用了催化剂,加快了反应速率 C、过程Ⅱ逆反应的活化能 D、催化剂通过参与反应改变反应历程、改变反应的活化能来改变化学反应速率
A、该反应为吸热反应 B、过程Ⅰ使用了催化剂,加快了反应速率 C、过程Ⅱ逆反应的活化能 D、催化剂通过参与反应改变反应历程、改变反应的活化能来改变化学反应速率 -
7、中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如图所示:

已知几种物质中化学键的键能如表所示:
化学键
键能
463
496
436
138
若反应过程中分解了水,则下列说法不正确的是( )
A、总反应为 B、该反应的 C、过程Ⅰ吸收了能量 D、过程Ⅱ和过程Ⅲ都只有新化学键的形成 -
8、氮及其化合物在科研及生产中均有重要的应用。(1)、转化为是工业制取硝酸的重要一步,一定条件下,与发生催化氧化反应时,可发生不同反应:
反应Ⅰ:
反应Ⅱ:
①该条件下,与反应生成的热化学方程式为.
②一定条件下的密闭容器中发生反应Ⅰ,平衡时混合物中的物质的量分数在不同温度(、、)随压强的变化如图所示。
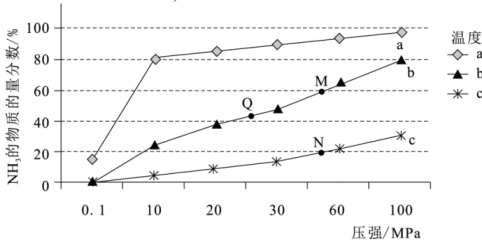
则曲线对应的温度是 , 点平衡常数的大小关系是。
(2)、已知: , 将气体充入的恒容密闭容器中,控制反应温度为随(时间)变化曲线如图。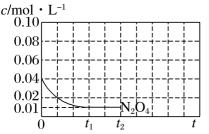
①下列各项中能说明该反应已达到化学平衡状态的是。
A.容器内压强不变 B.
C.混合气体的颜色不变 D.混合气体的密度不变
②时刻反应达到平衡,若 , 计算内的平均反应速率 , 此时的转化率为。
③反应温度时,画出时段,随变化曲线。保持其他条件不变,改变反应温度为 , 再次画出时段,随变化趋势的曲线。(在答题卡方框中完成)
-
9、某小组设计实验测定可逆反应的平衡常数并探究影响化学平衡移动的因素。
已知:常温下,反应(白色)和(红色)的平衡常数分别为、。
(1)、Ⅰ.配制溶液
用绿矾配制 , 为防止配制过程中变质,常加入少量的和(填试剂名称)。(2)、Ⅱ.测定的平衡常数常温下,将溶液和溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液X。
用溶液滴定测定滤液中浓度。
①量取滤液X。用(填“酸式”或“碱式”)滴定管取一定体积滤液X于锥形瓶中,若滴定管未用滤液润洗,对浓度测定结果是(填“偏高”、“偏低”或“无影响”)。
②用溶液滴定滤液中。滴定终点的现象为:当最后半滴溶液滴入后, , 此时为滴定终点。重复三次实验,实验数据如下表所示。根据表中数据计算出的滤液中的平均浓度是(用含的计算式表示)。
实验编号
滤液的体积
滴定前溶液的体积读数
滴定后溶液的体积读数
1
10.00
3.10
23.06
2
10.00
0.50
20.50
3
10.00
2.36
22.40
(3)、计算。若测得滤液中 , 则该反应的平衡常数。(用含的计算式表示)(4)、Ⅲ.探究稀释对该反应平衡移动方向的影响常温下,用溶液和溶液,按下表配制总体积相同的系列溶液,测定平衡时浓度,记录数据。
实验编号
ⅰ
10
10
0
ⅱ
4
① , 。
②和存在的关系是(用含和的不等式表示),该关系可以作为判断稀释对该反应平衡移动方向影响的证据。
-
10、工业上常用溶液除去烟气中的 , 某小组设计如图所示装置(a、b电极均为石墨),对除硫后产物溶液进行电解,制得和循环再生。
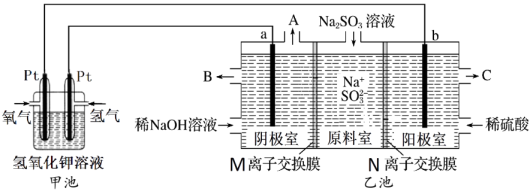 (1)、甲池中通入氧气的一端为极(填“正”或“负”),写出通入氢气的电极反应式。(2)、①乙池中阳极室口流出的是较浓的 , 则为(填“阳”或“阴”)离子交换膜,写出阳极室的电极反应式。
(1)、甲池中通入氧气的一端为极(填“正”或“负”),写出通入氢气的电极反应式。(2)、①乙池中阳极室口流出的是较浓的 , 则为(填“阳”或“阴”)离子交换膜,写出阳极室的电极反应式。②阴极室中溶液浓度增大的原因是:阴极室中水电离出的(用离子符号或化学式填空,下同)得电子反应生成 , 其浓度减小,使溶液中浓度增大,为了保持阴极室溶液中阴阳离子电荷平衡,从原料室向阴极室迁移,从而使阴极室中的浓度增大。
(3)、在标准状况下,若甲池中有参加反应,理论上乙池可生成。(4)、比能量是指参与反应单位质量的电极材料所能输出电能的多少,电池输出电能与反应的电子转移数目成正比。理论上,与均作负极时,它们的比能量之比为。 -
11、氨基乙酸铜被广泛应用于染料、涂料、塑料和电池等领域,其化学式为 , 结构如图所示。
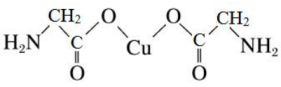 (1)、基态原子的电子排布式为 , 位于元素周期表中区元素(填“s、p、d、ds和f”其中一个)。(2)、氨基乙酸铜中碳原子的杂化方式有、 , 该分子中有个键。(3)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用表示,与之相反的用表示,称为电子的自旋磁量子数。对于基态原子,其价电子自旋磁量子数的代数和为。(4)、原子的第一电离能比原子的(填“大”或“小”),其原因是。(5)、氨基乙酸铜可由碳酸铜、氯乙酸、乙二胺等制得,碳酸铜中的VSEPR模型名称为 , 氯乙酸的酸性大于乙酸的原因是。
(1)、基态原子的电子排布式为 , 位于元素周期表中区元素(填“s、p、d、ds和f”其中一个)。(2)、氨基乙酸铜中碳原子的杂化方式有、 , 该分子中有个键。(3)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用表示,与之相反的用表示,称为电子的自旋磁量子数。对于基态原子,其价电子自旋磁量子数的代数和为。(4)、原子的第一电离能比原子的(填“大”或“小”),其原因是。(5)、氨基乙酸铜可由碳酸铜、氯乙酸、乙二胺等制得,碳酸铜中的VSEPR模型名称为 , 氯乙酸的酸性大于乙酸的原因是。 -
12、臭氧在烟气脱硝中的反应为。向的恒容密闭容器中充入和充分反应,平衡时,的体积分数随温度变化关系如图所示。下列说法正确的( )
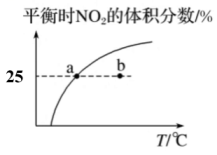 A、该反应的 B、点时,的体积分数为 C、点时, D、正反应速率的大小:点点
A、该反应的 B、点时,的体积分数为 C、点时, D、正反应速率的大小:点点 -
13、时,用的溶液分别滴定体积均为且浓度均为的及溶液,其滴定曲线如图。
已知:时,及溶度积常数依次为 , 下列说法正确的是( )
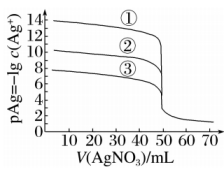 A、 B、滴定曲线①表示的滴定曲线 C、滴定时,可加入少量的作指示剂 D、当溶液滴定至时,溶液中
A、 B、滴定曲线①表示的滴定曲线 C、滴定时,可加入少量的作指示剂 D、当溶液滴定至时,溶液中 -
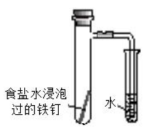
14、实验是学习化学的重要途径。下列所示装置图能达到实验目的的是( )
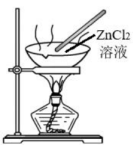
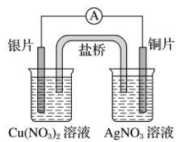
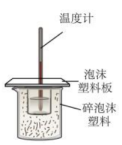
A.制备晶体
B.探究铁的吸氧腐蚀
C.铜银原电池装置
D.测定中和反应的反应热
A、A B、B C、C D、D -
15、光照条件下,甲烷氯化反应是一个自由基型的取代反应。在链转移反应过程中,经历两步反应(和分别表示甲基和氯原子)。反应1:;
反应2:。各物质的相对能量变化如图所示。下列说法不正确的是( )
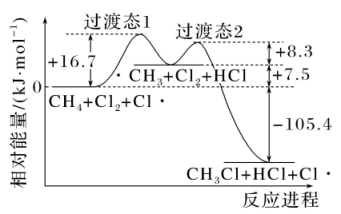 A、链转移反应的反应速率由第1步反应决定 B、反应1的活化能 C、由图可知,过渡态结构的稳定性: D、链转移反应的反应热
A、链转移反应的反应速率由第1步反应决定 B、反应1的活化能 C、由图可知,过渡态结构的稳定性: D、链转移反应的反应热 -
16、下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是( )
选项
陈述Ⅰ
陈述Ⅱ
A
工业用电解熔融制备金属钠
金属钠的还原性很强
B
在高温和高压条件下,和在催化剂作用下合成氨
升高温度、增大压强均可使反应物分子中活化分子的百分数增加
C
氨气作冷库中的制冷剂
氨气极易溶于水
D
溶液导电性比同浓度醋酸强
溶液的比醋酸的高
A、A B、B C、C D、D -
17、常温下,有关下列四种溶液的叙述中,正确的是( )
编号
①
②
③
④
溶液
氨水
溶液
醋酸
盐酸
11
11
3
3
A、在溶液①和②中分别加入适量的氯化铵晶体后,两溶液的均增大 B、分别取上述四种溶液稀释到 , 稀释后溶液的:①②③④ C、将溶液②、③等体积混合,所得溶液存在 D、将溶液②与溶液④混合,若所得溶液的 , 体积为 , 则 -
18、设为阿伏加德罗常数的值,下列说法正确的是( )A、(重水)含有的电子数为 B、在精炼铜的过程中,当阴极生成时,转移电子数为 C、溶液中阴阳离子数目之和为 D、一定条件下,与充分反应后,产物的分子数为
-
19、甲~戊均为短周期元素,在元素周期表中的相对位置如图所示。丁和戊的最高价氧化物对应的水化物均为强酸。下列说法不正确的是( )
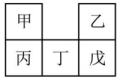 A、原子半径:丙>甲>乙 B、元素电负性:戊>丁>丙 C、氢化物的沸点:戊>乙 D、四个丙原子构成丙分子的空间结构模型是正四面体
A、原子半径:丙>甲>乙 B、元素电负性:戊>丁>丙 C、氢化物的沸点:戊>乙 D、四个丙原子构成丙分子的空间结构模型是正四面体 -
20、劳动创造美好生活。下列选项中劳动项目与化学知识没有关联的是( )
选项
劳动项目
化学知识
A
电焊工焊接金属时用溶液除锈
受热易分解
B
护士用葡萄糖溶于蒸馏水配制葡萄糖注射液
葡萄糖和水都是极性分子,葡萄糖易溶于水
C
营业员将水果放在冰箱中保鲜
温度降低,反应速率减小
D
烟花燃放人员燃放焰火
电子从高能级向低能级跃迁时放出能量
A、A B、B C、C D、D