-
1、用表示阿伏加德罗常数的值,下列说法正确的是( )A、的溶液中,所含的总数为 B、将含的饱和溶液滴入沸水中制得胶体,形成的胶粒数为 C、与足量溶液反应,转移电子数为 D、常温常压下,氧气和臭氧的混合气体含氧原子数是
-
2、下列反应同时有离子键、极性共价键和非极性共价键的断裂和形成的是( )A、 B、 C、 D、
-
3、下列有关物质检验实验结论正确的是( )A、取适量待测溶液于试管中,加足量稀盐酸,无明显现象,再滴加硝酸银溶液,出现白色沉淀,说明原待测溶液中一定含有 B、取一根洁净的铂丝,在酒精灯火焰上灼烧至无色,然后蘸取少量待测溶液,置于火焰上灼烧,火焰呈黄色,则原待测溶液中一定含有 C、取适量待测溶液于试管中,滴入适量新制氯水溶液,无明显现象,再滴入足量KSCN,溶液变为血红色,则原待测溶液中一定含有 D、取适量待测溶液于试管中,滴入适量澄清石灰水,产生白色沉淀,则原待测溶液中一定含有
-
4、现加热的碳酸钠和碳酸氢钠的混合固体使碳酸氢钠完全分解,固体质量变为 , 则原混合固体中碳酸钠的质量分数为( )A、 B、 C、 D、
-
5、在甲、乙两烧杯的溶液中,分别含有中的三种(每种离子不重复使用),已知甲烧杯中滴入石蕊试液呈红色,则乙烧杯中含有的离子是( )A、 B、 C、 D、
-
6、侯氏制碱法以饱和溶液、为原料制取纯碱,下列实验室模拟侯氏制碱法制取纯碱的步骤对应的装置或操作不正确的是( )




A.制取
B.制取
C.过滤固体
D.灼烧分解
A、A B、B C、C D、D -
7、胶体是一种重要的分散系,下列有关叙述正确的是( )A、溶液用于伤口止血与胶体的性质有关 B、静电除尘,利用了胶体带电的性质 C、能否发生丁达尔效应是胶体和溶液的本质区别 D、可用滤纸除去淀粉溶液中混有的氯化钠
-
8、化学用语是学习化学的重要工具,下列表述错误的是( )A、的电子式:
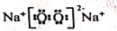 B、氮气分子的电子式:
B、氮气分子的电子式: C、中子数为8的氧原子:
D、的结构式:
C、中子数为8的氧原子:
D、的结构式:
-
9、下列离子方程式书写正确的是( )A、将钠粒投入水中: B、氯化亚铁溶液与等物质的量的氯气反应: C、氢氧化钡溶液与稀硫酸的反应: D、用醋酸溶解水垢中的:
-
10、化学贯穿古今,下列对诗词中所涉及化学知识的解读不正确的是( )A、“错把陈醋当成墨,写尽半生纸上酸”,陈醋是混合物 B、“熬胆矾铁斧,久之亦化为铜”,该过程涉及氧化还原反应 C、“火树银花合,星桥铁锁开”,诗词中所涉及的焰色试验是化学变化 D、“朱门酒肉臭,路有冻死骨”,“朱门”中含有
-
11、下列仪器名称正确的是( )
选项
A
B
C
D
仪器




名称
长颈漏斗
蒸发皿
容量瓶
圆底烧瓶
A、A B、B C、C D、D -
12、为倡导“节能减排”和“低碳经济”,降低大气中CO2含量及有效地开发利用CO2 , 工业上可用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入1molCO2、3molH2 , 一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。经测得CO2和CH3OH的物质的量随时间变化如图所示。
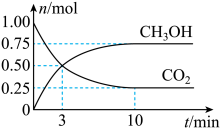 (1)、写出该反应的化学平衡常数表达式:K=。(2)、在3min末,反应速率v(正)v(逆)(选填>、<或=)。(3)、从反应开始到平衡,平均反应速率v(CO2)=。达到平衡时,H2的转化率为。(4)、下列措施可以加快反应速率的是____。A、升高温度 B、加入催化剂 C、增大压强 D、及时分离出CH3OH(5)、若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为:甲:v(H2)=0.45mol•L-1•s-1;乙:v(CO2)=0.2mol•L-1•s-1;丙:v(CH3OH)=6mol•L-1•min-1 , 则甲、乙、丙三个容器中反应速率由快到慢的顺序为。
(1)、写出该反应的化学平衡常数表达式:K=。(2)、在3min末,反应速率v(正)v(逆)(选填>、<或=)。(3)、从反应开始到平衡,平均反应速率v(CO2)=。达到平衡时,H2的转化率为。(4)、下列措施可以加快反应速率的是____。A、升高温度 B、加入催化剂 C、增大压强 D、及时分离出CH3OH(5)、若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为:甲:v(H2)=0.45mol•L-1•s-1;乙:v(CO2)=0.2mol•L-1•s-1;丙:v(CH3OH)=6mol•L-1•min-1 , 则甲、乙、丙三个容器中反应速率由快到慢的顺序为。 -
13、研究金属腐蚀和防腐的原理很有现实意义,回答下列问题:(1)、某化学实验兴趣小组同学利用如图所示装置进行实验:
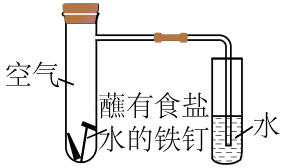
①该实验为(填“析氢”或“吸氧”)腐蚀。
②实验进行一段时间后,在右侧小试管中,可观察到的现象为。
③在左侧大试管中,正极上发生反应的电极反应式为。
(2)、实际生产中,可在铁的表面镀铜防止铁被腐蚀(如图所示):
①a为电源的(填“正极”或“负极”),判断的理由为。
②电镀时,Fe电极上发生反应的电极反应式为。
③电镀过程中,电解质溶液的pH将(填“增大”、“减小”或“不变”)。
④电镀时,当电路中转移0.2mol电子时,此时两电极的质量差为g(假设起始两电极的质量相等)。
-
14、自然界中的铝元素以化合物的形式存在于各种矿石中、某铝土矿的主要成分是 , 含少量SiO2、Fe2O3等杂质。从该铝土矿中提取铝可采用如下工艺流程(不考虑其它杂质参与反应):
已知:不溶于水且不与盐酸反应;能与NaOH溶液反应,生成可溶性盐。
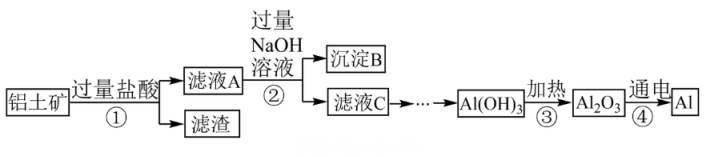
请回答下列问题。
(1)、步骤①加盐酸前先将铝土矿粉碎的目的是;所得滤液A中的溶质有种。(2)、步骤②中所加NaOH溶液须过量的目的是。(3)、步骤③加热分解生成两种氧化物,请写出该反应的化学方程式。(4)、步骤④是通过电解熔融状态的制备铝。的熔点是 , 很难达到熔融状态,工业上通过加入冰晶石使其在1000℃左右熔化,请写出这一做法的意义。氧化亚铜()可用于电镀工业。干法生产粉末的主要工艺流程如下:
 (5)、粉碎机中,发生的变化属于(填“物理变化”或“化学变化”)。(6)、时,煅烧炉中发生化合反应,该反应的化学方程式为。
(5)、粉碎机中,发生的变化属于(填“物理变化”或“化学变化”)。(6)、时,煅烧炉中发生化合反应,该反应的化学方程式为。 -
15、某学习小组为了探究一定温度下(简写为HAc)电离平衡的影响因素,进行了如下实验。(1)、【实验一】测定HAc的浓度。
用(填仪器名称)准确移取20.00 mL HAc溶液,转移至锥形瓶,加入2滴。(填“酚酞”。“石蕊”或“甲基橙”)作指示剂,用0.1000 mol/L NaOH溶液滴定,平行测定4次,消耗NaOH溶液的体积分别为20.05 mL、20.00 mL、18.40 mL、19.95 mL,则mol·L-1。(2)、滴定管在洗涤前应先检查。实验操作中,滴定管盛装NaOH溶液后排气泡动作正确的是(填字母,下同)。A.
 B.
B. C.
C. D.
D. (3)、下列有关实验操作的说法错误的是____。A、锥形瓶盛装HAc溶液前未干燥,对测定结果无影响 B、滴定时,左手控制滴定管活塞,右手握持锥形瓶,眼睛注视滴定管中的液面变化 C、滴定前仰视读数,滴定后读数正确,测得醋酸浓度偏低 D、接近滴定终点时,改为滴加半滴NaOH溶液,溶液出现颜色变化,即达到滴定终点(4)、【实验二】探究25℃下HAc电离平衡的影响因素。
(3)、下列有关实验操作的说法错误的是____。A、锥形瓶盛装HAc溶液前未干燥,对测定结果无影响 B、滴定时,左手控制滴定管活塞,右手握持锥形瓶,眼睛注视滴定管中的液面变化 C、滴定前仰视读数,滴定后读数正确,测得醋酸浓度偏低 D、接近滴定终点时,改为滴加半滴NaOH溶液,溶液出现颜色变化,即达到滴定终点(4)、【实验二】探究25℃下HAc电离平衡的影响因素。将实验一中的HAc溶液和与其等浓度的(简写为NaAc)溶液按一定体积比混合,测pH。
序号
V(HAc)/mL
V(NaAc)/mL
/mL
pH
Ⅰ
40.00
0
2.86
Ⅱ
4.00
36.00
0
3.36
…
Ⅶ
4.00
a
b
3∶4
4.53
Ⅷ
4.00
4.00
32.00
1∶1
4.65
根据表中信息,补充数据:a= , b=。
(5)、对比实验Ⅰ和Ⅱ可得结论:稀释HAc溶液,电离平衡正向移动;结合表中数据,给出判断理由:;由实验Ⅱ~Ⅷ可知,增大浓度,HAc电离平衡向移动(填“正”、“逆”)。 -
16、某温度下,将和体积均相同的和溶液分别加水稀释,其随加水体积的变化如图所示。下列叙述不正确的是( )
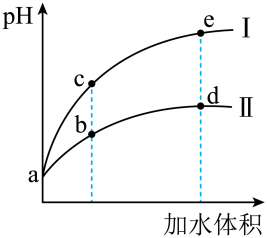 A、稀释前溶液的浓度: B、溶液中水的电离程度:b点点 C、从b点到d点,溶液中逐渐增大 D、曲线Ⅱ表示的是稀释的过程
A、稀释前溶液的浓度: B、溶液中水的电离程度:b点点 C、从b点到d点,溶液中逐渐增大 D、曲线Ⅱ表示的是稀释的过程 -
17、将0.20mol NO和0.20mol CO混合气体充入容积为1.0L的恒容密闭容器中,分别在和温度下发生反应:。反应过程中容器内的物质的量随时间变化关系如图所示,下列说法正确的是( )
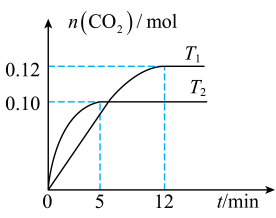 A、的 B、温度时,前12分钟的平均反应速率 C、温度时,该反应的平衡常数 D、温度时,若起始向容器中通入0.10mol NO、0.30mol CO、0.10mol和0.10mol , 反应向正方向进行
A、的 B、温度时,前12分钟的平均反应速率 C、温度时,该反应的平衡常数 D、温度时,若起始向容器中通入0.10mol NO、0.30mol CO、0.10mol和0.10mol , 反应向正方向进行 -
18、用新型甲醇燃料电池电源电解硫酸铜溶液,下列有关说法正确的是( )
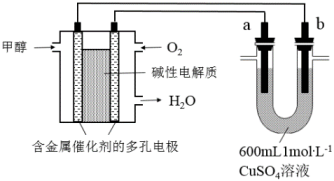 A、甲醇一极的电极反应式为CH3OH-6e-+H2O=CO2↑+6H+ B、若a为纯铜,b为粗铜,则该装置可用于粗铜的电解精炼 C、若a、b均为石墨,b极反应为:4OH--4e-=2H2O+O2↑ D、若a、b均为石墨,标准状况下消耗3.36L O2 , 则b极析出铜19.2g
A、甲醇一极的电极反应式为CH3OH-6e-+H2O=CO2↑+6H+ B、若a为纯铜,b为粗铜,则该装置可用于粗铜的电解精炼 C、若a、b均为石墨,b极反应为:4OH--4e-=2H2O+O2↑ D、若a、b均为石墨,标准状况下消耗3.36L O2 , 则b极析出铜19.2g -
19、常温下,下列各组离子一定能大量共存的是( )A、的溶液中:、、、 B、含有的溶液中:、、、 C、的溶液中:、、、 D、水电离产生的的溶液中:、、、
-
20、在一定条件下,将与加入到1L的密闭容器中,发生反应 , 充分反应后,测得平衡时的浓度为。此条件下平衡常数K为( )A、0.5 B、1 C、2 D、4