-
1、如图为某反应的微观示意图。下列说法正确的是( )
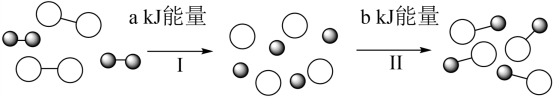 A、该反应为可逆反应 B、过程Ⅰ吸收热量,过程Ⅱ放出热 C、反应物的总能量小于生成物的总能量 D、加压一定能加快反应速率
A、该反应为可逆反应 B、过程Ⅰ吸收热量,过程Ⅱ放出热 C、反应物的总能量小于生成物的总能量 D、加压一定能加快反应速率 -
2、25℃时,水的电离达到平衡: , 下列叙述正确的( )A、将水加热,增大,pH变小 B、向水中加入稀氨水,平衡逆向移动,减小,减小 C、向水中加入少量气体,平衡逆向移动,减小,减小 D、向水中加入少量固体碳酸氢钠,增大,变大
-
3、设阿伏加德罗常数的值为NA , 下列说法正确的是( )A、1molNa2O2与足量水反应后转移的电子数为2NA B、常温常压下,56gFe与足量的盐酸完全反应转移的电子数为3NA C、同温同压下,等质量的H2和O2的体积之比是16∶1 D、1mol的Na2O2固体中含有离子数为4NA
-
4、酸碱中和滴定中常用以下仪器,其中为碱式滴定管的是( )A、
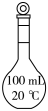 B、
B、 C、
C、 D、
D、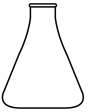
-
5、下列反应属于吸热反应的是( )A、KOH+HF=KF+H2O B、NH4Cl+NaOHNH3+H2O+NaCl C、CaO+H2O=Ca(OH)2 D、C+O2CO2
-
6、下列设备工作时,将化学能转化为热能的是( )
A
B
C
D




燃气灶
铅蓄电池
太阳能热水器
风力发电
A、A B、B C、C D、D -
7、如图所示的装置,下列说法不正确的是( )
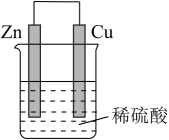 A、锌片为负极 B、该装置将化学能转化为电能 C、电子由锌片经导线流向铜片 D、铜片溶解,质量减少
A、锌片为负极 B、该装置将化学能转化为电能 C、电子由锌片经导线流向铜片 D、铜片溶解,质量减少 -
8、下列说法错误的是( )A、煤、石油、天然气是当今世界最重要的三种化石燃料 B、化学反应必伴随能量的变化 C、化学反应释放的能量一定是热能 D、有化学键断裂的变化不一定是化学变化
-
9、(Ⅰ)科学家积极探索新技术利用合成低碳烯烃:
, 测得温度对的平衡转化率和催化剂催化效率的影响如图1所示,请回答:

图1(1)、上述由合成的反应在(填“高温”或“低温”)下自发进行.理由是 .(2)、在体积为的恒容密闭容器中,充入和 , 测得温度对的平衡转化率和催化剂催化效率的影响如图1所示.下列说法正确的是____.A、平衡常数大小: B、其他条件不变,若不使用催化剂.则时的平衡转化率可能位于点 C、图1中点时,乙烯的体积分数约为 D、压强或不变时均可证明化学反应已达到平衡状态(3)、(Ⅱ)利用干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响,反应历程的能量变化如图2所示.图2
 图3
图3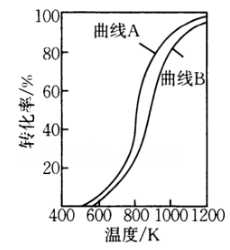
干重整反应的热化学方程式为(选用的关系式表示反应热),反应Ⅱ是(填“慢反应”或“快反应”).
(4)、在恒压条件下,等物质的量的和发生干重整反应时,各物质的平衡转化率随温度变化如图3所示.已知在干重整中还发生了副反应: , 则表示平衡转化率的是曲线(填“A”或“B”),判断的依据是 . -
10、(Ⅰ)环戊二烯(
 )是重要的有机化工原料,与人们的生活生产密切相关,广泛用于农药、橡胶、塑料等生产.试回答下列问题: (1)、已知反应:①
)是重要的有机化工原料,与人们的生活生产密切相关,广泛用于农药、橡胶、塑料等生产.试回答下列问题: (1)、已知反应:①
②
对于反应:③
 . (2)、某温度下,等物质的量的碘和环戊烯(
. (2)、某温度下,等物质的量的碘和环戊烯( )在刚性容器内仅发生反应③,起始总压为 , 平衡时总压增加了 , 环戊烯的平衡转化率为 , 该反应的平衡常数(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留三位有效数字).达到平衡后,保持不变,欲增加环戊烯的平衡转化率,可采取的措施有(填标号).
)在刚性容器内仅发生反应③,起始总压为 , 平衡时总压增加了 , 环戊烯的平衡转化率为 , 该反应的平衡常数(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留三位有效数字).达到平衡后,保持不变,欲增加环戊烯的平衡转化率,可采取的措施有(填标号).A.通入稀有气体 B.提高温度 C.增加环戊烯浓度 D.增加浓度
(3)、(Ⅱ)近年全国各地雾霾严重,为有效控制雾霾,各地积极采取措施改善大气质量.研究并有效控制空气中氨氧化物等污染物是一项重要而艰巨的工作.一定条件下,将与置于恒容密闭容器中发生反应: , 下列状态能说明该反应达到化学平衡的是____(填字母编号).
A、混合气体的密度保持不变 B、的转化率保持不变 C、和的物质的量之比保持不变 D、的消耗速率和的消耗速率相等(4)、已知反应 , 在不同条件时的体积分数随时间的变化如图1所示.根据图像可以判断曲线对应的下列反应条件中不同的是(填压强、温度、催化剂),理由是 .
图1
-
11、湿法炼锌净化钴渣中含有和的单质及 , 可利用过硫酸钠氧化水解法实现钴的富集,同时分别回收锌、铜和铁元素,工艺流程如下:

该工艺条件下,有关金属离子开始沉淀和沉淀完全的见下表:
金属离子
开始沉淀的
1.9
7.5
7.7
沉淀完全的
3.2
9.0
9.2
已知:一种离子的浓度时已沉淀完全;的还原产物为 .
回答下列问题:
(1)、将净化钴渣研细的目的是 .(2)、浸渣的主要成分为(填化学式).(3)、钴属于铁系元素,性质与铁相似.根据流程可知:的还原性(填“强于”或“弱于”) .(4)、常温下,利用上述表格数据.计算的 . 如果滤液Ⅰ中浓度为 , 则“除铁”应控制的范围是 .(5)、氨水可代替沉钴工序中的 , 此时发生的主要反应的离子方程式为 .(6)、上述流程中____(填标号)可返回湿法炼锌系统,提高锌的利用率.A、浸渣 B、滤渣Ⅰ C、滤液Ⅱ D、滤渣Ⅱ -
12、用草酸及草酸盐的性质可测定人体血液中钙离子的浓度.方法如下:抽取的血液样品,加入足量的草酸铵溶液,可析出草酸钙沉淀,将此草酸钙沉淀洗涤后溶于足量强酸可得草酸溶液,然后用的酸性标准溶液滴定草酸溶液,根据消耗酸性标准溶液的体积即可测定血液样品中的浓度.已知草酸为二元弱酸.(1)、结合滴定实验原理,分析下列问题:
①酸性标准溶液滴定草酸溶液的离子方程式为;本实验(填“需要”或“不需要”)另加指示剂;如何判断滴定终点: .
②若消耗的酸性标准溶液为 , 则该血液样品中的浓度为 .
③下列操作会使测得的血液样品中的浓度偏高的是 .
A.滴定管未用标准溶液润洗 B.草酸钙沉淀洗涤不充分
C.滴定前仰视读数并记录数据 D.盛放草酸溶液的锥形瓶没有干燥
(2)、为了探究外因对酸性标准溶液和草酸溶液反应速率的影响,现有学习小组完成以下实验:向三只比色血中加入酸性标准溶液各 , 再向其中分别加入稀硫酸各 , 然后再分别加入的溶液 , 通过手持色度计和数据采集器测定溶液透光率随时间的变化曲线如图1所示.

图1 相同浓度与相同浓度溶液在不同酸度下的反应曲线
①由图1分析,你能得出的结论是 .
②以稀硫酸的变化曲线为例.前后曲线变化幅度不同的原因是 .
-
13、乙醇是重要的有机化工原料,可由乙烯气相直接水合法制取,已知等物质的量的和的混合气体在一定的条件下反应: , 乙烯的平衡转化率与温度、压强的关系如图.下列说法不正确的是( )
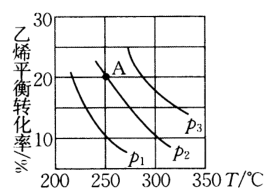 A、压强由小到大顺序为 B、当温度从升高到时,增大的倍数大于 C、A点混合气体中的体积分数为 D、若保持其他条件不变,将容器改为恒压密闭容器,则的平衡转化率将增大
A、压强由小到大顺序为 B、当温度从升高到时,增大的倍数大于 C、A点混合气体中的体积分数为 D、若保持其他条件不变,将容器改为恒压密闭容器,则的平衡转化率将增大 -
14、是我国科学家最近开发的双功能催化剂,它能促进甲醇燃料电池(DMFC)放电.某学习小组设计甲醇燃料电池为电源利用膜技术原理和电化学原理制备绿色硝化剂 , 模拟装置如图所示.下列叙述正确的是( )

甲 乙
A、完全反应时理论上乙池可制备 B、工作时,甲池中由交换膜右侧向左侧迁移 C、阳极电极反应式为 D、在甲池中滴加少量稀硝酸,能降低极反应的活化能 -
15、时,在水中的沉淀溶解平衡曲线如图.时的 , 下列说法正确的是( )
 A、通过蒸发,可使溶液由点变化到点 B、图中点碳酸钙的结晶速率小于其溶解速率 C、在时,从转化为更容易实现 D、可将锅炉中的转化为 , 再用醋酸去除
A、通过蒸发,可使溶液由点变化到点 B、图中点碳酸钙的结晶速率小于其溶解速率 C、在时,从转化为更容易实现 D、可将锅炉中的转化为 , 再用醋酸去除 -
16、部分弱电解质的电离常数如下表:
弱电解质
电离常数
下列说法错误的是( )
A、结合的能力: B、 C、中和等体积、等的和消耗的量前者小于后者 D、时,反应的平衡常数约为 -
17、活泼自由基与氧气的反应一直是关注的热点.自由基与反应过程的能量变化如图所示,下列说法正确的是( )
 A、该反应为吸热反应 B、产物的稳定性: C、该历程中正反应的最大活化能 D、相同条件下,由中间产物转化为产物的速率:
A、该反应为吸热反应 B、产物的稳定性: C、该历程中正反应的最大活化能 D、相同条件下,由中间产物转化为产物的速率: -
18、相同状况下,将装有和空气的集气瓶分别按如图甲、乙两种方式放置,中间用玻璃板隔开,抽掉玻璃板后,下列现象预测和分析错误的是( )
甲
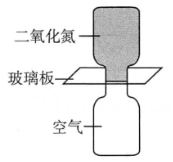 乙
乙
选项
现象预测
分析
A
甲盛的集气瓶气体颜色较快变浅
密度比空气大
B
乙盛空气的集气瓶出现红棕色
熵增的方向是自发的
C
经过足够长的时间,所有瓶中气体颜色相同
最终可以达到相同的平衡状态
D
所有集气瓶中气体颜色均变深
反应逆向移动
A、A B、B C、C D、D -
19、下列相关说法不能用勒夏特列原理解释的是( )A、加压能增大在水中的溶解度 B、升温可促进冰融化成水 C、对组成的平衡体系加压,颜色加深 D、大部分盐类水解符合“越稀越水解”的规律
-
20、在水中存在溶解平衡: , 下列能使减少的是( )A、加入溶液 B、加入少量固体 C、加入溶液 D、加入固体