-
1、已知A、B、D均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去)。则下列有关物质的推断不正确的是( )
 A、若A为碳,则E可能为氧气 B、若A为Na2CO3 , 则E可能为稀HCl C、若A为Fe,E为稀HNO3 , 则D为Fe(NO3)3 D、若A为AlCl3 , 则D可能为Al(OH)3 , E不可能为氨水
A、若A为碳,则E可能为氧气 B、若A为Na2CO3 , 则E可能为稀HCl C、若A为Fe,E为稀HNO3 , 则D为Fe(NO3)3 D、若A为AlCl3 , 则D可能为Al(OH)3 , E不可能为氨水 -
2、下列说法正确的是( )A、胶体区别于其他分散系的本质特征是丁达尔效应 B、碱性氧化物一定是金属氧化物 C、储氢合金吸收、放出氢气的过程是物理变化 D、1mol不同物质的体积大小主要取决于构成微粒的间距
-
3、某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与的个数之比为11∶1,则Cl2与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为( )A、1∶3 B、4∶3 C、2∶1 D、3∶1
-
4、化学与生活生产密切相关。下列物质应用过程没有发生化学变化的是( )A、氯气消毒剂 B、绳锯木断 C、水滴石穿 D、纯碱液去污
-
5、下列指定反应的离子方程式正确的是( )A、溶液腐蚀铜制印刷线路板: B、向溶液中通入 , C、用铝粉和NaOH溶液反应制取少量: D、溶液中加足量溶液:
-
6、下列关于无机物应用的叙述正确的是( )A、湿法脱除烟气中的NO,是利用的氧化性 B、半导体工业中可用氢氟酸除去硅片表面的层,是因为HF具有强酸性 C、法利用溶液脱除烟气中的 , 是利用溶液呈酸性 D、用氨水除去铜器表面的转化为 , 是利用的还原性
-
7、下列离子方程式正确的是( )A、铁与稀硫酸反应的离子方程式:2Fe+6H+=2Fe3++3H2↑ B、硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ C、Na2CO3溶液中滴加几滴稀盐酸:CO32-+H+=HCO3- D、澄清石灰水与少量小苏打溶液混合:Ca2+2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
-
8、下列化学用语中正确的是( )A、CO2电子式是
 B、次氯酸的结构式为H—Cl—O
C、N原子的轨道表示式为:
B、次氯酸的结构式为H—Cl—O
C、N原子的轨道表示式为: D、硫离子的结构示意图:
D、硫离子的结构示意图:
-
9、铟产业被称为“信息时代的朝阳产业”。元素周期表中铟的数据见下图,下列说法正确的是( )
 A、铟元素的质量数是114.8 B、铟元素的相对原子质量是115,中子数为66 C、铟元素是一种主族元素,位于第五周期第ⅢA族 D、铟原子最外层有5个电子
A、铟元素的质量数是114.8 B、铟元素的相对原子质量是115,中子数为66 C、铟元素是一种主族元素,位于第五周期第ⅢA族 D、铟原子最外层有5个电子 -
10、下列用品的主要成分及其用途对应不正确的是( )
A
B
C
D
用品
铁罐车




主要成分
Fe
NaHCO3
Si
Fe2O3
用途
可运输浓硫酸
发酵
光导纤维
涂料
A、A B、B C、C D、D -
11、美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成,直径约6到9纳米。“纳米车”可以用来运输单个的有机分子。下列说法正确的是( )
 A、人们用肉眼可以清晰看到“纳米车”的运动 B、在合适的分散剂中形成的分散系是胶体 C、C60是一种新型的化合物 D、C60与12C是同位素
A、人们用肉眼可以清晰看到“纳米车”的运动 B、在合适的分散剂中形成的分散系是胶体 C、C60是一种新型的化合物 D、C60与12C是同位素 -
12、钙是构成人体骨骼和牙齿的重要成分,这里的“钙”是指( )A、钙单质 B、碳酸钙 C、钙原子 D、钙元素
-
13、为探究锌和FeCl3溶液的反应,室温下某小组同学进行了如下实验。(1)、配置1000mL 1mol/L的FeCl3溶液,pH约为0.70,即c(H+)=0.2mol·L−1。
①从反应条件考虑,影响FeCl3水解平衡的因素有(答两点)。
②取10mL 1mol/L的FeCl3溶液加水稀释,盐的水解程度(填“增大”、“减小”或“不变”)。
(2)、小组同学利用上述FeCl3溶液探究其与锌粉的反应。向500mL FeCl3溶液中加入65g锌粉,实现现象记录如下:
i.实验前期,溶液的pH逐渐增大,锌粉表面未发现气泡;
ⅱ.随着反应的进行,观察到瓶底产生红褐色沉淀,同时出现少量气泡;
ⅲ.15分钟后溶液中产生大量气泡;
ⅳ.……
①经实验确认“实验前期”溶液中有Fe2+生成,确认有Fe2+的实验操作和现象是 , 结合平衡移动原理解释:实验前期溶液pH增大的原因。
②查阅资料发现:Fe(OH)3常温下的溶度积常数为2.810-39 , 请写出Fe(OH)3的沉淀溶解平衡表达式 , 试从Ksp-Q关系角度结合具体数值分析反应开始c(H+)=0.2mol·L−1时,没有出现红褐色沉淀的原因。
③结合离子方程式解释反应过程中气泡变化的原因。
(3)、锌和FeCl3溶液反应后溶液中Cl-浓度的测定。用c mol·L-1AgNO3标准溶液滴定反应后溶液中的Cl- , 采用K2CrO4为指示剂,利用Ag+与CrO生成砖红色沉淀指示滴定终点,实现操作如下:
i.以醋酸纤维滤膜过滤掉水样中的悬浮物,调节水样pH在6.5~10.5;
ⅱ.取10.00mL水样,加入K2CrO4溶液作指示剂,用AgNO3标准溶液滴定至终点,消耗AgNO3溶液VmL。
①滴定时,AgNO3标准溶液应加到(填玻璃仪器名称)中。
②锌和FeCl3溶液反应后溶液中Cl-浓度为(用含c的代数式表示)mol·L-1
③已知:Cr2O(黄色)+H2O2H++2CrO(橙色),解释滴定时调节水样pH在6.5~10.5的原因。
-
14、(1)、已知:25 ℃、101 kPa时,C(s)+1/2O2(g)=CO(g) ΔH1=-110.5 kJ/molC(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
试回答下列问题:
①碳的燃烧热是:(填“ΔH1”或“ΔH2”);
②CO(g)+1/2O2(g)=CO2(g) ΔH=kJ/mol。(2)、在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g)N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:①5秒内,v(NO2)=mol/(L·s);
②若将该容器置于冰水中,气体颜色将(填“变深”“变浅”或“不变”);
③该反应的平衡常数表达式K=。
(3)、NaHSO3是中学化学常见的物质。HSO3-在水溶液中存在如下两个平衡:HSO3-⇌H++SO32- Ka2
HSO3-+H2O⇌H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2 , 则0.1 mol/L NaHSO3溶液:
①溶液呈(填“酸性”“碱性”或“中性”);
②溶液中c(Na+)c(HSO3-)(填“>”“<”或“=”)。
(4)、将除锈后的铁钉用饱和食盐水浸泡一下,放入右图所示的具支试管中。①几分钟后,可观察到导管中的水柱;

A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的;
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为。
-
15、某废合金的主要成分为Sn、Cu、Pb、Fe,一种综合回收的工艺流程如图所示:

已知:常温下, , , 。
回答下列问题:
(1)、“氯化浸出”浸出液中金属阳离子主要有、、;浸渣的主要成分为(填化学式)。“氯化没出”时温度不宜过高或过低的原因是。(2)、写出“还原”中Fe与反应的化学方程式:。(3)、常温下,为使完全沉淀,“调pH”时应使溶液pH不低于(结果保留1位小数)。(4)、“氧化”时为检验是否已被充分氧化,可取样滴加(填化学式)溶液。(5)、写出“沉铁”时发生反应的离子反应方程式:。(6)、受热后可制得物质A,写出物质A的一种用途:。 -
16、溶液A中可能含有K+、Na+、Fe3+、Al3+、、、Cl-、中的若干种,且各离子浓度均相同,某同学设计并完成如下实验。
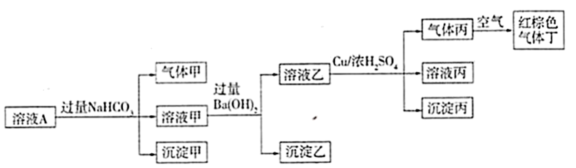
根据以上的实验操作与现象,下列有关说法不正确的是( )
A、Fe3+和Al3+不能同时存在 B、要确定溶液A中是否存在Na+或K+中的一种,只能通过焰色反应 C、沉淀乙中一定含有BaCO3和BaSO4 D、溶液A可能是由AlCl3、NaNO3、Al2(SO4)3按物质的量之比为1:3:1混合而成的溶液 -
17、已知: pH=-lgc(H+), pOH=-lgc(OH-)。 常温下,向某浓度的盐酸溶液中滴加氢氧化钠溶液,所得溶液pOH和pH变化如图所示。 下列说法正确的是( )
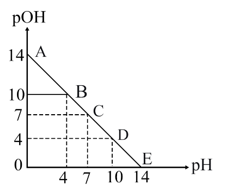 A、盐酸与NaOH溶液的浓度相等 B、B点和D点水的电离程度相同 C、滴加NaOH溶液改为滴加氨水溶液,该图曲线不变 D、升高温度,滴定过程中pOH+pH>14
A、盐酸与NaOH溶液的浓度相等 B、B点和D点水的电离程度相同 C、滴加NaOH溶液改为滴加氨水溶液,该图曲线不变 D、升高温度,滴定过程中pOH+pH>14 -
18、下列有关实验及其分析叙述正确的是( )A、向2.0mL浓度均为0.1mol⋅L-l的KCl、KI混合溶液中滴加1~2滴0.01mol/LAgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大 B、在稀硫酸中加入铜粉,铜粉不溶解;再加入适量的H2O2 , 铜粉仍不溶解 C、向AlCl3溶液中滴加氨水,产生白色沉淀;再加入NaHSO4溶液,沉淀不消失 D、将CO2通入Ba(NO3)2溶液中至饱和,无沉淀产生;再通入SO2 , 也无沉淀产生
-
19、若NA表示阿伏加 德罗常数的值,下列叙述正确的是( )
①标准状况下,2.24 L四氯化碳含碳原子数为0.1NA
②标准状况下,a L的氧气和氮气的混合物含有的分子数为NA
③电解精炼铜时,若阴极得到电子数为2NA , 则阳极质量减少64 g
④7 g CnH2n中含有的氢原子数为2NA
⑤常温下,7.1 g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA
⑥1 L 2 mol·L-1的FeCl3溶液中含Fe3+数为2NA
⑦2 L 1 mol·L-1的盐酸中所含氯化氢分子数为2NA
A、①④ B、②⑥ C、③④⑤ D、②⑤ -
20、我国科学家首次探索的碱性锌-空气电池放电时的工作原理如图所示。下列叙述错误的是( )
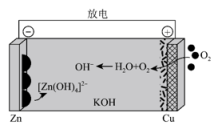 A、放电时,KOH溶液的浓度增大 B、放电时,负极的电极反应式为 C、充电时,铜极与直流电源的正极连接 D、充电时,当阴极质量净增26g时,理论上转移0.8mol电子
A、放电时,KOH溶液的浓度增大 B、放电时,负极的电极反应式为 C、充电时,铜极与直流电源的正极连接 D、充电时,当阴极质量净增26g时,理论上转移0.8mol电子