-
1、下列实验过程中不会出现颜色变化的是( )A、木炭粉与氧化铜共热 B、二氧化碳通入烧碱溶液 C、活性炭加入红墨水中 D、二氧化碳通入石蕊溶液
-
2、某化学兴趣小组通过以下实验探究,加深对化学反应速率和化学反应限度的认识,并测定化学反应的平衡常数。(1)、实验一:探究温度和浓度对反应速率的影响
【实验原理及方案】在酸性溶液中,碘酸钾和亚硫酸钠可发生反应生成碘,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
上述表格中:=mL,=。实验序号
酸性溶液(含淀粉)的体积/mL
溶液的体积/mL
水的体积/mL
实验温度/℃
记录出现蓝色的时间/s
①
5
5
0
②
5
5
40
25
③
5
35
25
(2)、酸性溶液中,碘酸钾和亚硫酸钠反应的离子方程式为。(3)、实验二:探究KI和的反应存在一定的限度【实验步骤】ⅰ.向溶液中滴加5~6滴溶液,充分反应后,将所得溶液分成甲、乙两等份;
ⅱ.向甲中滴加 , 充分振荡;
ⅲ.向乙中滴加溶液。
证明反应存在一定限度的实验现象是:步骤ⅱ中;步骤ⅲ中。
实验三:测定反应的平衡常数K
常温下,取2个碘量瓶分别加入下表中的试剂,振荡半小时。取一定体积的上层清液用标准溶液进行滴定,测定和的总浓度。
编号
碘量瓶①
碘量瓶②
试剂
研细的碘
溶液
研细的碘
和的总浓度
(4)、不能用普通锥形瓶代替碘量瓶的原因。(5)、为了判断用溶液滴定上层清液时的滴定终点,需要选择的指示剂为。(6)、0.5g的碘不需要精确称量的理由是:在水中或KI溶液中, , 故I2(aq)浓度不随碘固体的质量增大而增大。(7)、碘量瓶①平衡体系中与②中接近,列出平衡常数K的计算式(只列出计算式即可,不要求计算)。 -
3、科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及部分物质未标出)。
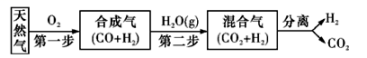 (1)、已知:CH4 、CO, 、H2的燃烧热分别为890. 3 kJ·mol-1、283. 0 kJ·mol-1、285. 8 kJ·mol-1。则上述流程中第一步反应2CH4(g)+O2(g)=2CO(g)+4H2(g)的△H=(2)、工业上可用H2和CO2制备甲醇,其反应方程式为CO2 ( g) + 3H2 (g)CH3OH(g)+ H2O(g)。某温度下,将1 mol CO2和3 mol H2充人体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:
(1)、已知:CH4 、CO, 、H2的燃烧热分别为890. 3 kJ·mol-1、283. 0 kJ·mol-1、285. 8 kJ·mol-1。则上述流程中第一步反应2CH4(g)+O2(g)=2CO(g)+4H2(g)的△H=(2)、工业上可用H2和CO2制备甲醇,其反应方程式为CO2 ( g) + 3H2 (g)CH3OH(g)+ H2O(g)。某温度下,将1 mol CO2和3 mol H2充人体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示: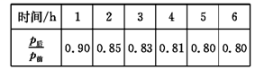
①用H2表示的前2h的平均反应速率v(H2)=
②该温度下,CO2的平衡转化率为
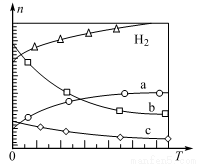
(3)、在300℃、8 MPa下,将CO2和H2按物质的量之比1:3通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(4)、CO2经催化加氢可合成低碳烯烃:2CO2 ( g)+6H2 (g)C2H4 (g)+4H2O(g) △H。在0 .1 MPa时,按(CO2):(H2)=1:3投料,如图所示为不同温度()下,平衡时四种气态物质的物质的量()的关系。①该反应的△H0(填“>”或“<”)。
②曲线表示的物质为(填化学式)。
-
4、一定温度(t℃)下,向1 L密闭容器中通入H2和 I2各0.15 mol,发生如下反应:H2(g) + I2(g) 2HI(g)。一段时间后达到平衡,测得数据如下:
t/min
2
4
7
9
n(I2)/mol
0.12
0.11
0.10
0.10
请回答:
(1)、2 min内,v(H2) =mol/(L·min)。(2)、下列能证明该反应已经达到平衡的是____(填字母)。A、v正(H2)= v逆 (HI) B、混合气体的颜色不再发生变化 C、混合气体中各组分的物质的量不再发生变化 D、混合气体的密度不再变化(3)、该反应的化学平衡常数表达式为。(4)、H2的平衡转化率是。(5)、该温度(t℃)下,若开始通入一定量的H2和 I2 , 反应达到平衡时,测得c(H2)=0.4mol/L,c(I2)=0.9mol/L,则平衡时c(HI)=mol/L。 -
5、石棉尾矿主要含有Mg3(Si2O5)(OH)4和少量的Fe2O3、Al2O3。以石棉尾矿为供源制备碳酸镁晶须(MgCO3·nH2O)的工艺如下:

已知“焙烧”过程中的主反应为:
Mg3(Si2O5)(OH)4+5(NH4)2SO4
 3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑(1)、写出焙烧产物NH3的电子式。(2)、为提高水浸速率,可采取的措施为(任写一条)。“浸渣”的主要成分为。(3)、“除铁、铝”时,需将pH调至8.0左右,适宜作调节剂的是(填字母代号)。
3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑(1)、写出焙烧产物NH3的电子式。(2)、为提高水浸速率,可采取的措施为(任写一条)。“浸渣”的主要成分为。(3)、“除铁、铝”时,需将pH调至8.0左右,适宜作调节剂的是(填字母代号)。a. NaOH b.Ca(OH)2 c.NH3·H2O
(4)、“沉镁”过程中反应的离子方程式为。(5)、流程中可以循环利用的物质是(填化学式)。 -
6、某杂志曾报道过某课题组利用磁性纳米Fe3O4颗粒除去水体中草甘膦污染物的方法,其原理如图所示(Fe3O4颗粒在水中表面会带-OH)。下列说法不正确的是( )
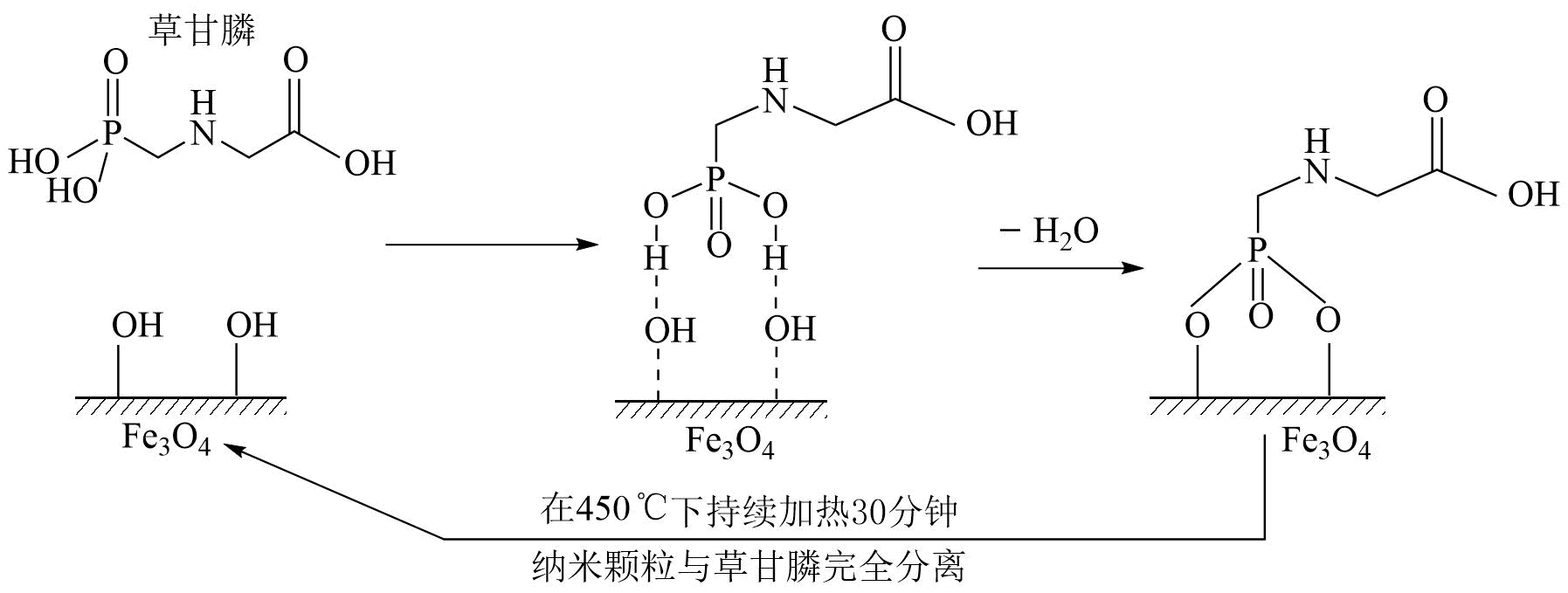 A、草甘膦能与氢氧化钠溶液反应 B、Fe3O4纳米颗粒除去草甘膦的过程有化学键的形成和断裂 C、溶液中c(H+)越大,Fe3O4纳米颗粒除污效果越好 D、处理完成后,Fe3O4纳米颗粒可用磁铁回收,经加热活化重复使用
A、草甘膦能与氢氧化钠溶液反应 B、Fe3O4纳米颗粒除去草甘膦的过程有化学键的形成和断裂 C、溶液中c(H+)越大,Fe3O4纳米颗粒除污效果越好 D、处理完成后,Fe3O4纳米颗粒可用磁铁回收,经加热活化重复使用 -
7、某小组探究与在不同条件下的反应,实验操作和现象记录如下:
实验
操作
现象
Ⅰ
、30%溶液混合
10h后,铜片表面附着黑色固体
Ⅱ
、30%溶液、氨水混合
立即产生大量气泡,溶液变为浅蓝色,铜表面光洁
Ⅲ
、30%溶液、氨水和固体混合
立即产生大量气泡,溶液蓝色较深,铜片依然保持光亮
下列说法错误的是( )
A、Ⅰ中与可以缓慢反应,可能生成 B、Ⅱ中可能发生的反应为 C、增大 , 的氧化性增强 D、增大有利于的生成 -
8、下列实验操作、现象、结论均完全正确的是( )
选项
操作
现象
结论
A
在常温下测定Na2CO3和NaHCO3溶液的pH
Na2CO3溶液pH较大
水解能力:Na2CO3大于NaHCO3
B
先向盛有1mL 0.1mol/L的AgNO3溶液的试管中滴加两滴0.1mol/L的NaCl溶液,再向其中滴加0.1mol/L的NaI溶液。
滴加NaCl溶液有白色沉淀生成,滴加NaI溶液后有黄色沉淀生成
AgCl沉淀可转化成AgI沉淀
C
电解饱和CuCl2溶液实验中,用润湿的淀粉—碘化钾试纸靠近阳极
润湿的淀粉—碘化钾试纸变蓝
阳极产生Cl2
D
饱和FeCl3溶液中加入少量NaCl固体
溶液颜色变浅
加入NaCl固体后,FeCl3的水解平衡逆向移动
A、A B、B C、C D、D -
9、常温下,等物质的量浓度的下列溶液中最大的是( )A、 B、 C、 D、
-
10、铝的冶炼在工业上通常采用电解Al2O3的方法,装置示意图如图。研究表明,电解AlCl3-NaCl熔融盐也可得到Al,熔融盐中铝元素主要存在形式为AlCl和Al2Cl。下列说法不正确的是( )
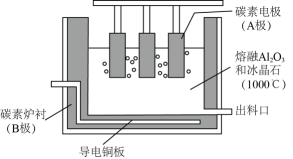 A、电解Al2O3装置中B电极为阴极,发生还原反应 B、电解Al2O3过程中碳素电极虽为惰性电极,但生产中会有损耗,需定期更换 C、电解AlCl3-NaCl时阴极反应式可表示为4Al2Cl+3e—=Al+7AlCl D、电解AlCl3-NaCl时AlCl从阳极流向阴极
A、电解Al2O3装置中B电极为阴极,发生还原反应 B、电解Al2O3过程中碳素电极虽为惰性电极,但生产中会有损耗,需定期更换 C、电解AlCl3-NaCl时阴极反应式可表示为4Al2Cl+3e—=Al+7AlCl D、电解AlCl3-NaCl时AlCl从阳极流向阴极 -
11、向某密闭容器中加入0.3mol A、0.1mol C和一定量B的混合气体,在一定条件下发生反应,各物质的浓度随时间变化如图甲所示(t0~t1阶段的c(B)变化未画出),图乙为t2时刻改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段各改变一种不同的反应条件。下列说法中正确的是( )
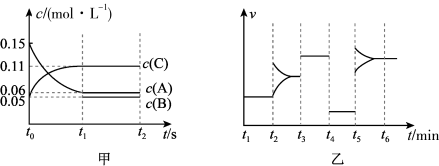 A、若t1="15" s,t0~t1阶段B的平均反应速率为0.004 mol·L-1·s-1 B、t4~t5阶段改变的条件是减小压强 C、该容器的容积为2 L,B的起始物质的量为0.02 mol D、t5~t6阶段,容器内A的物质的量减少了0.06 mol,容器与外界的热交换为a kJ,则该反应的热化学方程式为3A(g)B(g)+2C(g) △H=-50a kJ·mol-1
A、若t1="15" s,t0~t1阶段B的平均反应速率为0.004 mol·L-1·s-1 B、t4~t5阶段改变的条件是减小压强 C、该容器的容积为2 L,B的起始物质的量为0.02 mol D、t5~t6阶段,容器内A的物质的量减少了0.06 mol,容器与外界的热交换为a kJ,则该反应的热化学方程式为3A(g)B(g)+2C(g) △H=-50a kJ·mol-1 -
12、室温下,下列实验探究方案能达到探究目的的是( )
选项
探究方案
探究目的
A
向2mL 0.1mol/L KI溶液中加入5mL 0.1mol/L溶液充分反应后用苯萃取2~3次,取水层滴加KSCN溶液观察溶液颜色变化
化学反应有一定限度
B
用玻璃棒蘸取待测溶液滴在pH试纸上,立即与pH标准比色卡对照读数
测定新制氯水的pH
C
分别向2支盛有等体积、等浓度的和溶液的试管中同时加入2mL溶液
探究不同催化剂对反应速率的影响
D
分别取50mL 0.5mol/L硫酸、氢氧化钠两溶液在量热器中充分反应,测定反应前后最大温度差
测定中和热
A、A B、B C、C D、D -
13、X、Y、Z三种气体,取X和Y按2∶1的物质的量之比混合,放入固定体积的密闭容器中发生如下反应:X + 2Y 2Z,达到平衡后,X的转化率不可能为( )A、10% B、15% C、20% D、25%
-
14、为了减缓铁与稀硫酸反应速率但不减少产生氢气的量,可以在稀硫酸中加入( )A、NaOH溶液 B、Na2CO3 溶液 C、Fe2O3 D、Na2SO4溶液
-
15、下列叙述中不正确的是( )A、电热水器用镁棒防止内胆腐蚀,采用的是牺牲阳极的阴极保护法 B、葡萄酒中含维生素C等多种维生素,通常添加微量防止营养成分被氧化 C、复方氢氧化铝、碳酸氢钠片、雷尼替丁等抗酸药均能抑制胃壁细胞分泌盐酸 D、2020年1月我国爆发了新冠肺炎疫情,可采用“84”消毒液来杀灭新型冠状病毒
-
16、500mL 1mol/L的硫酸与足量的铁屑完全反应。计算:生成的H2的体积(标准状况)。
-
17、将30mL0.5mol/LNaOH溶液加水稀释到500mL。计算:稀释后NaOH溶液中的物质的量浓度。
-
18、下表列出了①~⑨九种元素在周期表中的位置。

回答下列问题:
(1)、①~⑨九种元素中,化学性质最不活泼的是(填元素符号)。(2)、元素②的原子结构示意图是 , 元素②与⑨组成的化合物中化学键类型为(填“离子键”或“共价键”)。(3)、元素②和③中原子半径较大的是(填元素符号)。(4)、元素③和④中气态氢化物稳定性较强的是(填化学式)。(5)、元素⑧和⑨的最高价氧化物对应的水化物中,酸性强的是(填化学式)。(6)、元素⑦的单质与⑥的最高价氧化物对应的水化物反应的离子方程式为。 -
19、氯气、“84”消毒液、漂白粉等都是含氯的消毒剂,某化学兴趣小组利用如图装置制备“84”消毒液、漂白粉,并收集纯净干燥的氯气。回答下列问题:
 (1)、盛装浓盐酸的仪器的名称为 , 装置甲中发生反应的化学方程式为。(2)、装置丁用来收集纯净且干燥的氯气,进气口为(填标号);装置乙和丙盛装的试剂分别是、(填名称)。(3)、将氯气通入装置己中制备漂白液,则装置己中发生反应的离子方程式为。(4)、装置戊中盛装石灰乳用来制备漂白粉,漂白粉的有效成分为(填化学式)。
(1)、盛装浓盐酸的仪器的名称为 , 装置甲中发生反应的化学方程式为。(2)、装置丁用来收集纯净且干燥的氯气,进气口为(填标号);装置乙和丙盛装的试剂分别是、(填名称)。(3)、将氯气通入装置己中制备漂白液,则装置己中发生反应的离子方程式为。(4)、装置戊中盛装石灰乳用来制备漂白粉,漂白粉的有效成分为(填化学式)。 -
20、研究物质性质及物质转化具有重要的价值,根据所学知识回答下列问题:(1)、按如图所示操作,充分反应后:

①II中发生反应的离子方程式为。
②结合I、II实验现象可知、、的氧化性由强到弱的顺序为。
(2)、高铁酸钠()是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为:①该反应中发生还原反应的物质是(填化学式,下同),氧化产物是。
②用双线桥法标出电子转移的数目和方向:。