-
1、下列实验操作、实验现象和所得结论描述正确的是( )
选项
实验操作和现象
结论
A
向盛有饱和Na2S2O3溶液的试管中滴加稀盐酸,溶液变浑浊且有气体生成
说明生成了S和H2S
B
向氨水中滴加少量AgNO3溶液,无沉淀生成
Ag+与NH3·H2O能大量共存
C
常温下,测得0.1 mol/LNaA溶液的pH大于0.1 mol/L Na2CO3溶液的pH
酸性:HA<H2CO3
D
向CuS的悬浊液中加入饱和MnSO4溶液可生成浅红色沉淀(MnS为浅红色)
说明Ksp(MnS) < Ksp(CuS)
A、A B、B C、C D、D -
2、下列说法中正确的是( )A、FeCl3溶液和Fe2(SO4)3溶液分别加热、蒸发、浓缩结晶、灼烧,所得固体的成分相同 B、实验室配制FeCl3溶液时,先将FeCl3溶于水,再加入少量的盐酸 C、向MgCl2溶液中加入MgO调节pH,可除去溶液中混有的Fe3+ D、室温下pH相同、体积相同的醋酸和盐酸两种溶液加水稀释相同的倍数后,两溶液的pH:醋酸>盐酸
-
3、下列热化学方程式中,△H能正确表示物质的燃烧热的是( )A、S(s)+O2(g)=SO2(g) △H B、C(s)+O2(g)=CO(g) △H C、H2(g)+O2(g)=H2O(g) △H D、2H2(g)+O2(g)=2H2O(g) △H
-
4、肌肉中大量肌红蛋白Mb可以结合O2形成MbO2维持人体的生理活动,发生反应:Mb(aq)+O2(g)MbO2(aq) ΔH,该过程可自发进行。温度为T时,平衡常数K= =2.0 kPa-1(气体分压=气体总压体积分数),下列说法中不正确的是( )A、ΔH<0 B、提高p(O2),K值变大 C、提高氧气浓度,有利于Mb(aq)的转化 D、当n(MbO2)/n(Mb)=4.0时,吸入的空气中p(O2)=21 kPa,该反应正向进行
-
5、下列说法正确的是( )A、在25℃、101 kPa,1 mol CH4(g)和2 mol CH4(g)的燃烧热相等 B、1 mol浓硫酸与1 mol NaOH溶液完全中和所放出的热量为中和热 C、工业合成氨的反应中加入催化剂可增大反应速率,同时提高反应物的平衡转化率 D、△H越大,说明反应热量变化越大
-
6、下列说法中正确的是( )A、用过滤方法提纯胶体 B、1molCH4和2molO2完全反应放出的热量就是CH4的燃烧热 C、1molO2在任何反应中完全反应时,都将得到4mole- D、NaClO溶液呈碱性的原因是:ClO-+H2O
 HClO+OH-
HClO+OH-
-
7、在测定中和热的实验中,下列说法正确的是( )A、在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、温度计、玻璃棒 B、完成一次中和反应反应热测定实验,温度计需要使用2次,分别用于测混合液的初始温度和反应最高温度 C、用50mL0.55mol/L的NaOH溶液与60mL0.50mol/L的盐酸反应,测得的中和热数值偏大 D、使用环形玻璃搅拌棒是为了使反应物充分混合减小实验误差
-
8、实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
 (1)、仪器A的名称是 , B中发生反应的离子方程式。(2)、D装置的作用是。(3)、E中为干燥的红色布条,F中为湿润的红色布条,可观察到的现象是 , 对比E和F中现象的差异可得出的结论是(4)、G处的现象是。(5)、H为尾气吸收装置,写出发生的化学方程式。
(1)、仪器A的名称是 , B中发生反应的离子方程式。(2)、D装置的作用是。(3)、E中为干燥的红色布条,F中为湿润的红色布条,可观察到的现象是 , 对比E和F中现象的差异可得出的结论是(4)、G处的现象是。(5)、H为尾气吸收装置,写出发生的化学方程式。 -
9、氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl、NHCl2和NCl3)。(1)、氯胺作饮用水消毒剂是因为水解生成具有强烈杀菌作用的物质,该物质的结构式为 , 二氯胺与水反应的化学方程式为。将0.01 mol NCl3通入100 mL 0.5 mol/L Na2SO3溶液中,转移电子的物质的量为mol。(2)、已知部分化学键的键能和化学反应的能量变化如下表和下图所示。
化学键
N-H
N-Cl
H-Cl
键能
391.3
x
431.8

则反应过程中的△H2=kJ·mol-1 , 表中的x=。
(3)、在密闭容器中反应NH3(g)+Cl2(g)NH2Cl(g)+HCl(g)达到平衡,通过热力学定律计算,不同温度下理论上NH2Cl的体积分数随的变化如下图所示。
①a、b、c三点对应平衡常数的大小关系是(分别用Ka、Kb、Kc表示)。b点时,该反应的平衡常数为;
②T2℃,Q点对应的速率:(填“>”、“<”或“=”);
③在氨氯比一定时,提高NH3的转化率的方法是(任写1种);
④若产物都是气体,实验测得NH2Cl的体积分数始终比理论值低,原因可能是。
-
10、某工厂以硝酸为原料生产亚硝酸钠,其工艺流程如图:

已知:Na2CO3+NO+NO2=2NaNO2+CO2
(1)、“分解塔”中SO2从塔底进入,硝酸从塔顶喷淋,其目的是。(2)、“分解塔”中的温度不宜过高,其原因是。(3)、按一定计量比在“分解塔”中通SO2和喷入硝酸,若反应后生成的NO与NO2物质的量之比恰好1:1,则“分解塔”中发生反应的化学方程式为。(4)、为提高氮氧化物的转化率,可向“尾气”中通入一定量的气体,再通入“吸收塔”中,实现循环吸收。(5)、“吸收塔”所得溶液中除含有NaNO2、NaNO3和少量Na2CO3外,还含有的溶质为(填化学式)。(6)、工业废气中NO2可用NaOH溶液吸收生成NaNO2和NaNO3 , 反应的离子方程式为。 -
11、某溶液中只可能含有下列离子中的几种(不考虑溶液中含的较少的H+和OH-):Na+、NH、SO、CO、NO。取200 mL该溶液,分为等体积的两份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224 mL。实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33 g。下列说法正确的是 ( )A、该溶液中一定含有Na+ , 且c(Na+)≥0.1 mol·L-1 B、该溶液中可能含有Na+ C、该溶液中一定不含NO D、该溶液中肯定含有NH、SO、CO、NO
-
12、下列各组反应,最终一定能得到白色沉淀的是( )A、向NaAlO2溶液中通入HCl气体 B、向Ba(OH)2溶液中通入过量CO2气体 C、向FeCl2溶液中加入过量NaOH溶液 D、向Al2(SO4)3溶液中加入过量NH3·H2O
-
13、为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(气密性良好)。
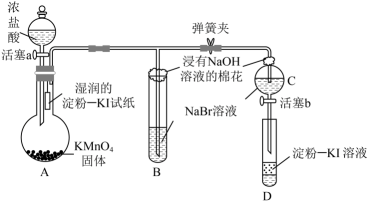
已知:浓盐酸与固体混合会产生。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.……
下列说法错误的是( )
A、A中湿润的淀粉-KI试纸变蓝,证明氯气的氧化性强于碘单质 B、B中溶液变黄色,证明氯气的氧化性强于溴单质 C、B中发生反应的离子方程式为 D、实验过程Ⅲ为关闭活塞a,打开活塞b,滴加溶液后充分振荡试管D,观察到D中溶液变蓝,即证明了溴单质的氧化性强于碘单质 -
14、下列根据实验现象所得出的结论中,一定正确的是( )A、无色溶液加入盐酸酸化的BaCl2溶液产生白色沉淀,结论:溶液中含SO42- B、无色溶液焰色反应呈黄色,结论:溶液是钠盐溶液 C、无色溶液加入稀盐酸产生无色无味的气体,结论:溶液中含CO32- D、无色溶液中加入氢氧化钠溶液,加热产生的气体使湿润的红色石蕊试纸变蓝,结论:溶液中含NH4+
-
15、用NA表示阿伏加 德罗常数的值,下列叙述正确的是( )A、常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA B、用CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA C、Na2O2与H2O反应生成1.12LO2(标准状况),反应转移的电子数为0.2NA D、标准状况下,80gSO3中含3NA个氧原子,体积约为22.4L
-
16、下列反应的现象描述与离子方程式都正确的是( )A、锌片插入硝酸银溶液中,有银析出:Zn+Ag+=Zn2++Ag B、氢氧化钡溶液与稀硫酸反应,有白色沉淀生成: +Ba2+=BaSO4↓ C、氢氧化铜加到盐酸中,无明显现象:Cu(OH)2+2H+=Cu2++2H2O D、碳酸钡中加入稀盐酸,固体溶解,生成无色无味气体:BaCO3↓+2H+=Ba2++CO2↑+H2O
-
17、下列叙述不正确的是( )A、将与HCl混合气体通过饱和食盐水可得到纯净的 B、漂白粉可用于生活用水的消毒 C、液氯可以储存在钢瓶中 D、氯水可用于漂白纸张、织物等
-
18、《本草纲目》中“石碱”条目下记载:“彼人采蒿蓼之属……晒干烧灰,以原水淋汁……久则凝淀如石……浣衣发面……”石碱的主要成分为。某同学按照如图所示流程制备少量石碱,下列说法错误的是( )
 A、过程①涉及氧化还原反应 B、加水溶解时可适当加热,以增大的溶解度和溶解速率 C、的热稳定性很差,受热易分解生成 D、图示方法的不足之处有二氧化碳排放较多和原料来源受限制等
A、过程①涉及氧化还原反应 B、加水溶解时可适当加热,以增大的溶解度和溶解速率 C、的热稳定性很差,受热易分解生成 D、图示方法的不足之处有二氧化碳排放较多和原料来源受限制等 -
19、人类对原子结构的认识经历了漫长的历史阶段。其中最早提出“原子核外电子是在原子轨道上运动的,并遵循一定的规律。”的科学家是( )A、道尔顿 B、汤姆生 C、卢瑟福 D、玻尔
-
20、北京奥运会主场馆“鸟巢”堪称建筑上的一个奇迹,它的主要建筑材料是合金。下列物质中属于合金的是( )A、金 B、银 C、钢 D、铜