-
1、下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。针对表中①~⑩号元素回答下列问题。
 (1)、①元素的名称是 , ⑨元素的原子结构示意图为。(2)、②、③、④、⑤、⑥五种元素中,原子半径由小到大的顺序是(填元素符号);这五种元素分别形成的简单离子中离子半径最小的是(填离子符号)。(3)、镓(Ga)与⑥同主族,其氢氧化物为两性氢氧化物,请写出氢氧化镓与NaOH反应的化学方程式。(4)、元素①和⑧的单质化合形成的化合物KH中H元素的化合价为;KH能与水反应生成氢气,在反应后的溶液中滴入酚酞,溶液变红,反应的化学方程式为。(5)、表中元素⑦和⑩的最高价氧化物对应水化物的酸性最强的是(填化学式)。(6)、元素④和⑥相比,金属性较强的是(填元素符号),下列能证明这一事实的有(填序号)。
(1)、①元素的名称是 , ⑨元素的原子结构示意图为。(2)、②、③、④、⑤、⑥五种元素中,原子半径由小到大的顺序是(填元素符号);这五种元素分别形成的简单离子中离子半径最小的是(填离子符号)。(3)、镓(Ga)与⑥同主族,其氢氧化物为两性氢氧化物,请写出氢氧化镓与NaOH反应的化学方程式。(4)、元素①和⑧的单质化合形成的化合物KH中H元素的化合价为;KH能与水反应生成氢气,在反应后的溶液中滴入酚酞,溶液变红,反应的化学方程式为。(5)、表中元素⑦和⑩的最高价氧化物对应水化物的酸性最强的是(填化学式)。(6)、元素④和⑥相比,金属性较强的是(填元素符号),下列能证明这一事实的有(填序号)。A.在化合物中④的化合价比⑥的低
B.④的单质能与冷水剧烈反应而⑥的单质不能
C.④的最高价氧化物对应水化物的碱性比⑥强
D.④单质的熔点比⑥单质的低
-
2、铁、铜混合粉末18g加入到溶液中,充分反应后,剩余固体的质量为2.8g。若反应前后溶液体积不变,下列说法正确的是( )A、反应后溶液中 B、原固体混合物中Cu的质量是9.6g C、反应后溶液中 D、反应后溶液中
-
3、短周期元素X、Y、Z、W、E的原子序数依次增大,由它们组成的一种医用试剂的结构式如图所示。X的原子核内有1个质子,E的原子比W的原子多8个电子。下列说法错误的是( )
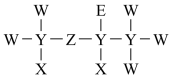 A、原子半径: B、非金属性: C、X、Y、Z三种元素可以形成二元酸,不能形成一元酸 D、X与Z和E均能形成含有18个电子的分子
A、原子半径: B、非金属性: C、X、Y、Z三种元素可以形成二元酸,不能形成一元酸 D、X与Z和E均能形成含有18个电子的分子 -
4、为了验证与能够相互转化,按下表操作进行实验:
操作顺序
对应现象
①向溶液中加入过量铁粉
②滴加溶液
③再滴加几滴氯水
①溶液由黄色变为浅绿色
②溶液无明显变化
③溶液变红
下列分析中不合理的是( )
A、解释现象①的反应为 B、操作②可说明操作①后的溶液中无 C、溶液变红涉及的反应有 D、比较氧化性: -
5、下列关于原子结构及微粒间的数量关系的说法正确的是( )A、同种元素的原子均有相同的质子数和中子数 B、微粒Na+、Mg2+、O2-具有相同的电子层结构 C、某元素原子的最外层只有2个电子,则该元素一定是金属元素 D、Ca2+的质子数比核外电子数少2
-
6、设NA为阿伏加德罗常数的值,下列说法正确的是( )A、和反应生成时转移电子数为0.4NA B、和混合物中所含的离子总数为0.3NA C、常温常压下,和混合气体中含有的碳原子数目为0.5NA D、足量的与的浓盐酸充分反应可制得氯气的分子数为0.3NA
-
7、下列对于“摩尔”的理解正确的是( )A、摩尔是国际科学界建议采用的一种物理量 B、摩尔可以把物质的宏观数量与微观粒子的数量联系起来 C、摩尔是物质的量的单位,简称摩,符号为mol D、国际上规定0.012kg碳中所含有的碳原子数目约为6.02×1023
-
8、下列离子方程式书写正确的是( )A、通入水中: B、过量的与澄清石灰水反应: C、溶液和溶液反应: D、钠与水反应:
-
9、钠、氯元素及其化合物十分重要。海水中蕴含着丰富的氯元素,主要以氯化钠、氯化镁等氯化物形式存在。人们通过物理方法和化学方法可以制得多种钠、氯化工产品,这些产品广泛地应用于生产生活中。下列有关Na2CO3和NaHCO3叙述错误的是( )A、热稳定性:Na2CO3>NaHCO3 B、澄清石灰水可用来鉴别Na2CO3和NaHCO3 C、在一定条件下,Na2CO3和NaHCO3之间可以相互转化 D、等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,放出的CO2的质量一样多
-
10、工业上高温炼铁的反应原理为: , 下列说法正确的是( )A、该反应是置换反应 B、Fe是还原剂 C、CO2是还原产物 D、CO是还原剂
-
11、下列有关钠及其化合物的性质与用途具有对应关系的是( )A、NaHCO3 受热易分解,可用于制膨松剂 B、Na2O2呈淡黄色,可用于消防员呼吸面具中的供氧剂 C、氢氧化钠具有强碱性,可用作干燥剂 D、碳酸钠显碱性,可以用于制抗酸药物
-
12、下列有关钠的叙述中,错误的是( )A、钠燃烧时发出黄色火焰,钠应保存在石蜡油或煤油中 B、钠的活泼性强于铜,因此钠可从溶液中置换出铜 C、在坩埚中加热钠,可观察到钠先融化,之后发出黄色火焰,生成淡黄色固体 D、钠的化学性质非常活泼,钠元素在自然界中只以化合态存在
-
13、下列水溶液中的电离方程式正确的是( )A、 B、 C、 D、
-
14、化学上把一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物叫做分散系。分散系按分散质粒子直径分类如图:
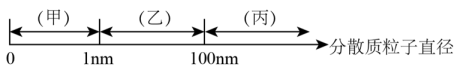
下列说法正确的是( )
A、澄清石灰水分类属于乙,澄清石灰水变浑浊后分类属于丙 B、云、雾、有色玻璃的分散质粒子直径范围在乙 C、甲、乙、丙的本质区别是能够发生丁达尔效应 D、向氢氧化钠溶液中缓慢滴加足量的氯化铁饱和溶液可制得氢氧化铁胶体 -
15、根据物质的组成对物质进行分类,下列物质属于碱性氧化物的是( )A、 B、 C、 D、HClO
-
16、电路板广泛用于计算机、手机等电子产品中。某兴趣小组拟制作带有“化学”标志的电路板并对废液进行回收利用。(1)、Ⅰ.制作电路板小组同学取一小块覆铜板,用油性笔在铜板上写出“化学”标志,然后浸入溶液中,一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板和废液(如下图所示)。

在覆铜板上制作出“化学”图案过程中发生反应的离子方程式为。(2)、检验废液中含有的试剂是(用化学式表示)。(3)、Ⅱ.回收废液:一种从腐蚀废液(含、、)回收金属铜并获得氯化铁晶体的工艺流程如下:
请根据流程,回答下列问题。(提示:为充分除去杂质,所加试剂均为过量)
腐蚀废液中加入药品①是(填字母)。
a.铁粉 b.氯化铁溶液 c.铜粉
(4)、④所代表的物质是(用化学式表示)。(5)、操作方法b是。(6)、若取2 mL溶液⑤加入试管中,然后滴加氢氧化钠溶液,产生白色沉淀,迅速变为灰绿色,一段时间后变为红褐色,此过程涉及氧化还原反应的化学方程式是。(7)、试剂⑥是时,该反应获得16.25 g无水氯化铁晶体,理论上消耗标准状况下L。有同学建议用代替以减少污染,写出试剂⑥是时发生反应的离子方程式是。 -
17、疫情防控中,含氯消毒剂发挥了重要作用。含氯消毒剂有多种,如、、NaClO、、。某化学兴趣小组利用NaOH溶液来制备含氯消毒剂。(1)、Ⅰ.配制一定物质的量浓度的NaOH溶液
配制250 mL 1.0 mol/L NaOH溶液,需用托盘天平称取g NaOH固体。配制该溶液除用到量筒、烧杯、玻璃棒外,还需要的玻璃仪器是。(2)、下列操作中,会造成所配溶液浓度偏低的是。a.容量瓶用蒸馏水洗涤后,没有经过干燥立即使用
b.溶液未经冷却立即转移到容量瓶中定容
c.没有洗涤烧杯和玻璃棒
d.向容量瓶加水定容时眼睛俯视观察刻度线
(3)、Ⅱ.利用如图装置制备“84”消毒液
实验室安全图标不仅能够提醒潜在的危险因素,还能够引导实验人员采取相应的防护措施,以下制备“84”消毒液的实验不需要标记的图标有(填标号)。






①护目镜
②锐器
③明火
④热烫
⑤排风
⑥洗手
(4)、仪器A的名称为。(5)、装置①中二氧化锰和浓盐酸反应制取氯气的化学方程式为。(6)、装置②中盛装的试剂为 , 用于除去中的HCl杂质。(7)、装置③中制得“84”消毒液,其有效成分是(填化学式)。(8)、清洗卫生间时,“84”消毒液和洁厕灵(主要成分是稀盐酸)不能混合使用,用离子方程式解释其原因为。(9)、含氯消毒剂中有效氯含量,能反映含氯消毒剂消毒能力的大小,其定义是每克含氯消毒剂的氧化能力相当于多少克氯气的氧化能力。则NaClO的有效氯含量为(保留小数点后两位)。 -
18、钠元素在自然界中以多种化合物的形式存在。NaCl、、、是重要的化工原料,具有多种用途。(1)、Ⅰ.完成下列问题
以上物质可在呼吸面具和潜水艇中作为氧气的来源的是 , 可治疗胃酸过多的是。(2)、查阅资料知:在一定条件下可以转化为 , 亚硝酸钠外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食会导致血红蛋白中的转化为而中毒,误食后可服用维生素C解毒,表明维生素C具有(填“氧化性”或“还原性”)(3)、Ⅱ.化工专家侯德榜发明的侯氏制碱法为我国经济发展做出了重要贡献。某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备 , 进一步处理得到产品和,实验流程如图:
回答下列问题:
产品可用作氮肥,属于(填“离子”或“共价”)化合物。
(4)、下图装置A和装置B均可用于实验室制备 , 其中装置A的优点是 , 和盐酸反应的离子方程式为。 (5)、向饱和氨盐水中通入会产生沉淀,从溶液中分离出沉淀的操作名称是。(6)、步骤②生成的化学方程式为 , 热稳定性(填“>”或“<”)。(7)、该方法制得的纯碱中往往会含有NaCl杂质,为检验杂质的存在,简单的检验方案是:取少量试样溶于水后,。
(5)、向饱和氨盐水中通入会产生沉淀,从溶液中分离出沉淀的操作名称是。(6)、步骤②生成的化学方程式为 , 热稳定性(填“>”或“<”)。(7)、该方法制得的纯碱中往往会含有NaCl杂质,为检验杂质的存在,简单的检验方案是:取少量试样溶于水后,。 -
19、人体必需的部分元素在周期表中的分布情况如下:

请根据以上信息回答下列问题:
(1)、元素③能维持人体水分平衡、酸碱平衡等,元素③在周期表中的位置为。(2)、人体缺元素⑦会导致腿软、抽筋、乏力、烦躁、精力不集中等症状,牛奶中含有大量的元素⑦,有利于骨骼健康。根据元素⑦在周期表中的位置预测牛奶中的元素⑦以形式存在。(填“离子”或“单质”)(3)、硒(Se)元素对人体的抗衰老具有很好的作用,同时能增强人体免疫力、抵抗力,具有抗癌、抗肿瘤等功效,元素Se的两种核素、互称为。(4)、人体中的①元素通过选择性清除恶性自由基,保护细胞分裂分化,达到抗细胞变异和抗癌变的效果,请写出元素①与元素②组成的含10个电子的分子的电子式:。(5)、人体血液中如果缺乏亚铁离子,就会造成缺铁性贫血,某种市售营养麦片中含有微量的铁粉,请写出铁粉在胃酸(主要成分HCl)中发生反应的离子方程式。(6)、适量的砷(As)有助于血红蛋白的合成,能够促进人体的生长发育,如果使用不当,砷对人体的危害就会非常的大,根据砷在周期表中位置预测非金属性AsSe(填“>”“<”或“=”)。(7)、人体应减少铝元素的摄入,铝元素可导致脑组织退行性病变,诱发老年痴呆等脑病,请写出铝与NaOH溶液反应的化学方程式。(8)、以上周期表信息中元素的最高价氧化物对应水化物酸性最强的是(填化学式)(9)、下列不能证明元素⑥的金属性比④强的事实有。a.元素⑥的原子最外层电子数比元素④的原子最外层电子数少。
b.⑥的单质能与冷水剧烈反应而④的单质不能
c.⑥的最高价氧化物对应水化物的碱性比④强
-
20、现有两等份含有酚酞的溶液,分别滴加稀、溶液,滴加速率始终相同,测得溶液的电导率随时间变化如图所示(单位体积溶液中离子所带电荷总数越多,电导率越大)。下列说法正确的是( )
 A、b曲线为滴加溶液的电导率变化 B、M点两种溶液恰好完全反应 C、a曲线电导率减小过程中,溶液由红色变为无色 D、M点溶液的电导率约为0,说明生成的物质都不是电解质
A、b曲线为滴加溶液的电导率变化 B、M点两种溶液恰好完全反应 C、a曲线电导率减小过程中,溶液由红色变为无色 D、M点溶液的电导率约为0,说明生成的物质都不是电解质