-
1、氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)、若某反应的平衡常数表达式为K= , 请写出此反应的热化学方程式:;下列措施能够增大此反应中NO的转化率的是(填字母代号)。a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)、向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。物质的量/mol
T1/℃
T2/℃
0
5 min
10 min
15 min
20 min
15 min
30 min
NO
2.0
1.16
0.80
0.80
0.50
0.40
0.40
N2
0
0.42
0.60
0.60
0.75
0.80
0.80
①T1℃,0~5min内,以CO2表示的该反应速率v(CO2)= , 该条件下的平衡常数K=。
②第15 min后,温度调整到T2 , 数据变化如上表所示,则T1 T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=。
-
2、如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中为离子交换膜。请按要求回答相关问题:
 (1)、甲烷燃料电池负极反应式是。(2)、电极的电极反应式为。(3)、应使用离子交换膜(填“阴”或“阳”)。(4)、写出图中电解饱和食盐水反应的离子方程式。(5)、若用装置丙模拟粗铜的精炼,则溶液中的铜离子应移向(填“”或“”)极,反应结束后硫酸铜溶液的浓度(填“变大”、“变小”或“不变”)。(6)、若在标准状况下,有氧气参加反应,则乙装置中铁电极上生成的气体体积为。
(1)、甲烷燃料电池负极反应式是。(2)、电极的电极反应式为。(3)、应使用离子交换膜(填“阴”或“阳”)。(4)、写出图中电解饱和食盐水反应的离子方程式。(5)、若用装置丙模拟粗铜的精炼,则溶液中的铜离子应移向(填“”或“”)极,反应结束后硫酸铜溶液的浓度(填“变大”、“变小”或“不变”)。(6)、若在标准状况下,有氧气参加反应,则乙装置中铁电极上生成的气体体积为。 -
3、、、、、是原子序数依次增大的五种短周期元素,其元素性质或原子结构如表。
元素
元素性质或原子结构
原子核外能级上的电子总数与能级上的电子总数相等,但第一电离能低于同周期相邻元素
在同周期元素中,原子半径最大
电离能()数据:;;;……
其价电子中,在不同形状的原子轨道中运动的电子数相等
只有一个不成对电子
(1)、的元素符号为、的基态原子价层电子轨道表示式为。(2)、元素处于元素周期表中的区(填“”或“”),其基态原子核外电子排布式为。(3)、的元素符号为 , 元素的第一电离能同周期相邻元素(填“高于”、“低于”或“等于”)。(4)、、和元素的电负性由大到小的顺序是(填元素符号)。(5)、、的最高价氧化物的水化物酸性更强的是(填化学式)。(6)、、和可以形成多种化合物,其中在室温下水溶液且的化合价为+1价的化合物是(填化学式)。 -
4、某温度下,体积和pH都相同的NaOH溶液与CH3COONa溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
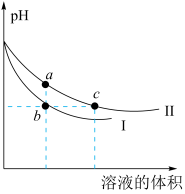 A、c点的溶液中c(OH−)+c(CH3COOH)=c(H+) B、a、b两点溶液的导电性:a>b C、b、c两点溶液中水的电离程度:b=c D、用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc
A、c点的溶液中c(OH−)+c(CH3COOH)=c(H+) B、a、b两点溶液的导电性:a>b C、b、c两点溶液中水的电离程度:b=c D、用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc -
5、关于下列电化学装置的说法正确的是( )
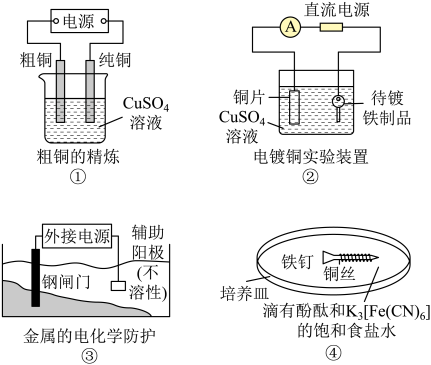 A、装置①的粗铜应与电源正极相连,精炼过程中两极质量的改变量相等 B、装置②的待镀铁制品应与电源正极相连,电镀过程中溶液的浓度保持不变 C、装置的钢闸门应与电源负极相连,属于“牺牲阳极的阴极保护法” D、装置④中靠近铜丝处出现红色,靠近裸露在外的铁钉处出现蓝色
A、装置①的粗铜应与电源正极相连,精炼过程中两极质量的改变量相等 B、装置②的待镀铁制品应与电源正极相连,电镀过程中溶液的浓度保持不变 C、装置的钢闸门应与电源负极相连,属于“牺牲阳极的阴极保护法” D、装置④中靠近铜丝处出现红色,靠近裸露在外的铁钉处出现蓝色 -
6、铅酸蓄电池是典型的可充电电池,电池总反应式为 , 工作原理如图所示,下列说法正确的是( )
 A、放电时,负极反应为: B、放电时,移向X极 C、充电时,Y极连接电源正极 D、充电时,Y极的电极反应为:
A、放电时,负极反应为: B、放电时,移向X极 C、充电时,Y极连接电源正极 D、充电时,Y极的电极反应为: -
7、对下列各溶液中,微粒的物质的量浓度关系表述正确的是( )A、的溶液中: B、的溶液中: C、的氨水中: D、在溶液中:
-
8、下列各组离子,一定能在溶液中大量共存的是( )A、使甲基橙变红的溶液:、、、 B、溶液中:、、、 C、的溶液:、、、 D、水电离的的溶液中:、、、
-
9、下列事实能用勒夏特列原理解释的是( )A、500℃左右高温比室温下更利于合成氨 B、工业制硫酸中SO2氧化为SO3 , 往往需要使用催化剂 C、H2、I2、HI平衡混合气体加压后颜色加深 D、工业制取金属钾Na(l)+KCl(l)NaCl(l)+K(g),使K变成蒸气从混合体系中分离
-
10、将和通入密闭容器中发生反应 , 通过实验得到不同条件下达到平衡时Z的物质的量分数与温度和压强的关系如图。下列关于该反应的的判断正确的是 ( )
 A、 B、 C、 D、
A、 B、 C、 D、 -
11、在恒温恒容的密闭容器中发生反应4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0,下列能说明该反应达到平衡状态的是( )
①反应速率5v(NH3)=4v(O2) ②体系的压强不再发生变化 ③混合气体的密度不再发生变化 ④气体的平均摩尔质量不再发生变化 ⑤单位时间内生成5 mol O2 , 同时断裂12 mol O—H键 ⑥NO的浓度不变
A、②④⑥ B、①②④⑥ C、②⑤⑥ D、①②③④⑤ -
12、下列说法中,正确的是( )A、难溶电解质达到沉淀溶解平衡时,保持温度不变增加难溶电解质的量,平衡向溶解方向移动 B、难溶电解质都是弱电解质 C、室温下,在水中的溶解度大于在饱和溶液中的溶解度 D、在白色沉淀上滴加溶液,沉淀变黑,说明比更难溶于水
-
13、下列对化学反应速率增大原因的分析正确的是( )A、对有气体参加的化学反应,增大压强使容器容积减小,单位体积内活化分子数增多 B、向反应体系中加入相同浓度的反应物,使活化分子百分数增大 C、升高温度,使反应物分子中活化分子数增多,活化分子百分数不变 D、加入适宜的催化剂,使反应物分子中活化分子数增多,活化分子百分数不变
-
14、下列说法正确的是( )A、已知C(石墨,s)(金刚石,s) , 则金刚石比石墨稳定 B、已知 , , 则 C、氢气的燃烧热为285.8 , 则表示氢气燃烧热的热化学方程式为 D、在一定条件下,将和置于密闭容器中充分反应,放出热量79.2 kJ,则该反应的热化学方程式为
-
15、某反应过程的能量变化如图所示,下列说法错误的是( )
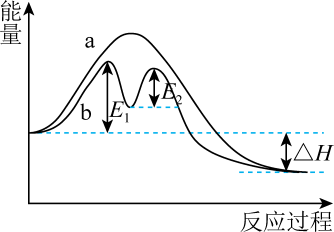 A、该反应为放热反应, B、过程b有催化剂参与 C、过程a的活化能大于 D、过程b中第二步反应是决速步骤
A、该反应为放热反应, B、过程b有催化剂参与 C、过程a的活化能大于 D、过程b中第二步反应是决速步骤 -
16、化学与科学、技术、社会、环境关系密切,下列说法错误的是( )A、明矾净水时能沉降水中的悬浮物,但不能杀菌消毒 B、草木灰与铵态氮肥混合施用会降低氮肥的肥效 C、金属焊接时可用饱和氯化铵溶液作除锈剂 D、用石墨电极电解熔融氯化铝可以制备金属铝
-
17、(1)、按要求写出下列反应的方程式。
①醋酸电离方程式:。
②一水合氨电离方程式:。
③碳酸氢钠与氢氧化钠反应离子方程式:。
(2)、在0.2 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如下图所示,回答下列问题:
①该混合液中,NaCl的物质的量为mol,含溶质MgCl2的质量为g。
②该混合液中CaCl2的物质的量为mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为mol·L-1。
-
18、已知A是一种常见金属,B的俗称为磁性氧化铁,C溶液呈浅绿色。试根据图中转化关系,回答下列问题。
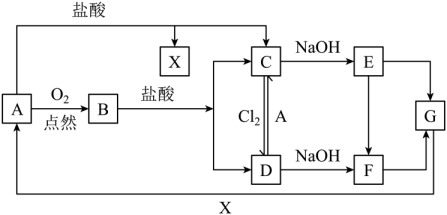 (1)、写出B和G的化学式:B、G;(2)、检验D中少量阳离子的最佳试剂的化学式是;(3)、实验室在长期保存C溶液的过程中会加入少量;(4)、写出下列转化的化学方程式:
(1)、写出B和G的化学式:B、G;(2)、检验D中少量阳离子的最佳试剂的化学式是;(3)、实验室在长期保存C溶液的过程中会加入少量;(4)、写出下列转化的化学方程式:① D→C ;
② C→D ;
(5)、E在空气中放置容易转化为F,产生的现象为。 -
19、实验室使用浓盐酸、二氧化锰共热制氯气,并用氯气和氢氧化钙反应制取少量漂白粉(该反应放热)。氯气和氢氧化钙在温度较高时会生成副产物氯酸钙,甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
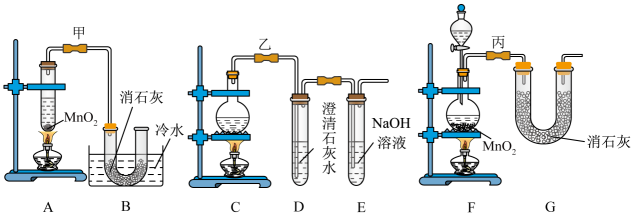 (1)、请写出实验室使用浓盐酸、二氧化锰共热制氯气的离子方程式:。(2)、哪位同学的装置能够有效地防止副反应的发生?。(3)、请写出氯气和氢氧化钙制备漂白粉的化学方程式:。(4)、上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)。(5)、实验中若用12mol·L-1的浓盐酸200mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3mol,其可能的主要原因是(假定各步反应均无反应损耗且无副反应发生)。
(1)、请写出实验室使用浓盐酸、二氧化锰共热制氯气的离子方程式:。(2)、哪位同学的装置能够有效地防止副反应的发生?。(3)、请写出氯气和氢氧化钙制备漂白粉的化学方程式:。(4)、上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)。(5)、实验中若用12mol·L-1的浓盐酸200mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3mol,其可能的主要原因是(假定各步反应均无反应损耗且无副反应发生)。 -
20、高铁酸钾()具有强氧化性,是一种环保、高效、多功能的水处理剂,实验室用含少量杂质的铁屑原料,经过如下流程制备少量。
 (1)、中铁元素的化合价是。(2)、往原料中添加过量KOH所发生反应的离子方程式为。(3)、检验“预氧化”环节是否已经实现要求的方法是。(4)、“制备”的反应中,还原剂和氧化剂的物质的量之比为。(5)、“熔融法”是最早发现+6价高铁酸盐的方法,该法制备高铁酸盐的原理如下:
(1)、中铁元素的化合价是。(2)、往原料中添加过量KOH所发生反应的离子方程式为。(3)、检验“预氧化”环节是否已经实现要求的方法是。(4)、“制备”的反应中,还原剂和氧化剂的物质的量之比为。(5)、“熔融法”是最早发现+6价高铁酸盐的方法,该法制备高铁酸盐的原理如下:若反应中被氧化的与被还原的之物质的量比为1∶4,请写出该反应配平后的方程式:。此时,若反应产生11.2L(标准状况) , 则转移的电子为mol。