-
1、绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr-Fe-Al-Mg的深度利用和内循环。工艺流程如下图:
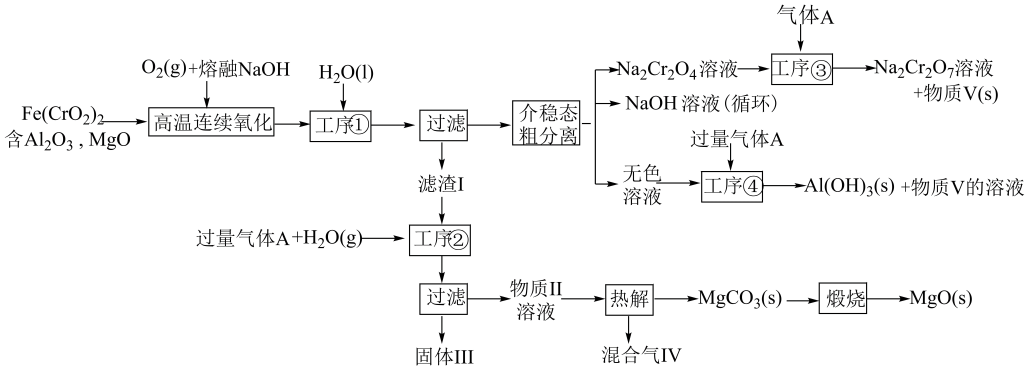
回答下列问题:
(1)、高温连续氧化工序中被氧化的元素是(填元素名称)。(2)、滤渣Ⅰ的主要成分是(填化学式)。(3)、工序③中发生反应的离子方程式为。(4)、物质Ⅴ可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为 , 可代替NaOH的化学试剂还有(填化学式)。(5)、热解工序产生的混合气体最适宜返回工序(填①、②、③或④)参与内循环。(6)、工序④溶液中的反应的化学方程式为。 -
2、碘化钠在医药中用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,也用作食品添加剂、感光剂等。工业上用NaOH溶液、水合肼制取碘化钠固体,其制备流程图如下:

已知:在100℃以上分解。
(1)、已知:在合成过程的反应产物中含有NaIO3 , 则在合成过程中消耗了3molI2 , 所生成NaIO3的物质的量为mol。(2)、写出还原过程中的离子方程式;在还原过程中,为了加快反应,可采取可提高反应温度,但温度不得超过℃;请选择下列试剂检测所得碘化钠固体中是否含有NaIO3杂质(选填字母)。A.FeCl2溶液 B.冰醋酸 C.KI溶液 D.淀粉溶液
(3)、测定产品中NaI含量的实验步骤如下:a.称取4.000g样品、溶解,在250mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入淀粉溶液作指示剂;
c.用的Na2S2O3溶液进行滴定至终点(发生反应的方程式为:),重复测定2次,所得的相关数据如下表:
测定序号
待测液体积/mL
标准液滴定管起点读数/mL
标准液滴定管终点读数/mL
1
25.00
006
24.04
2
25.00
0.02
24.02
3
25.00
0.12
24.14
①操作b中,加入足量的FeCl3溶液时所发生的离子方程式为。
②滴定终点观察到的现象为。
③计算该样品中NaI的含量为。(只写出有具体数值的表达式即可)
(4)、碘化钠固体的保存方法是。 -
3、过二硫酸是一种疏的含氧酸,化学式。它的结构可以表示成。它的盐称为过二硫酸盐,在工业上用途广泛,用作强氧化剂等。下列反应分别是与过二硫酸盐和高锰酸盐反应的离子方程式(未配平),下列说法中错误的是( )
Ⅰ.
Ⅱ.
A、过二硫酸根中显价的氧原子和显价的氧原子的数目比是3∶1 B、反应Ⅰ中氧化剂和还原剂物质的量之比是3∶2 C、反应Ⅱ中每生成 , 转移电子的物质的量为 D、若反应Ⅰ和反应Ⅱ中消耗的的物质的量相同,则Ⅰ和Ⅱ中消耗的氧化剂的物质的量之比为2∶5 -
4、Cl2O能与水反应生成次氯酸,可杀死新型冠状病毒等多种病毒。一种制备Cl2O的原理为HgO+2Cl2=HgCl2+Cl2O,装置如图所示。
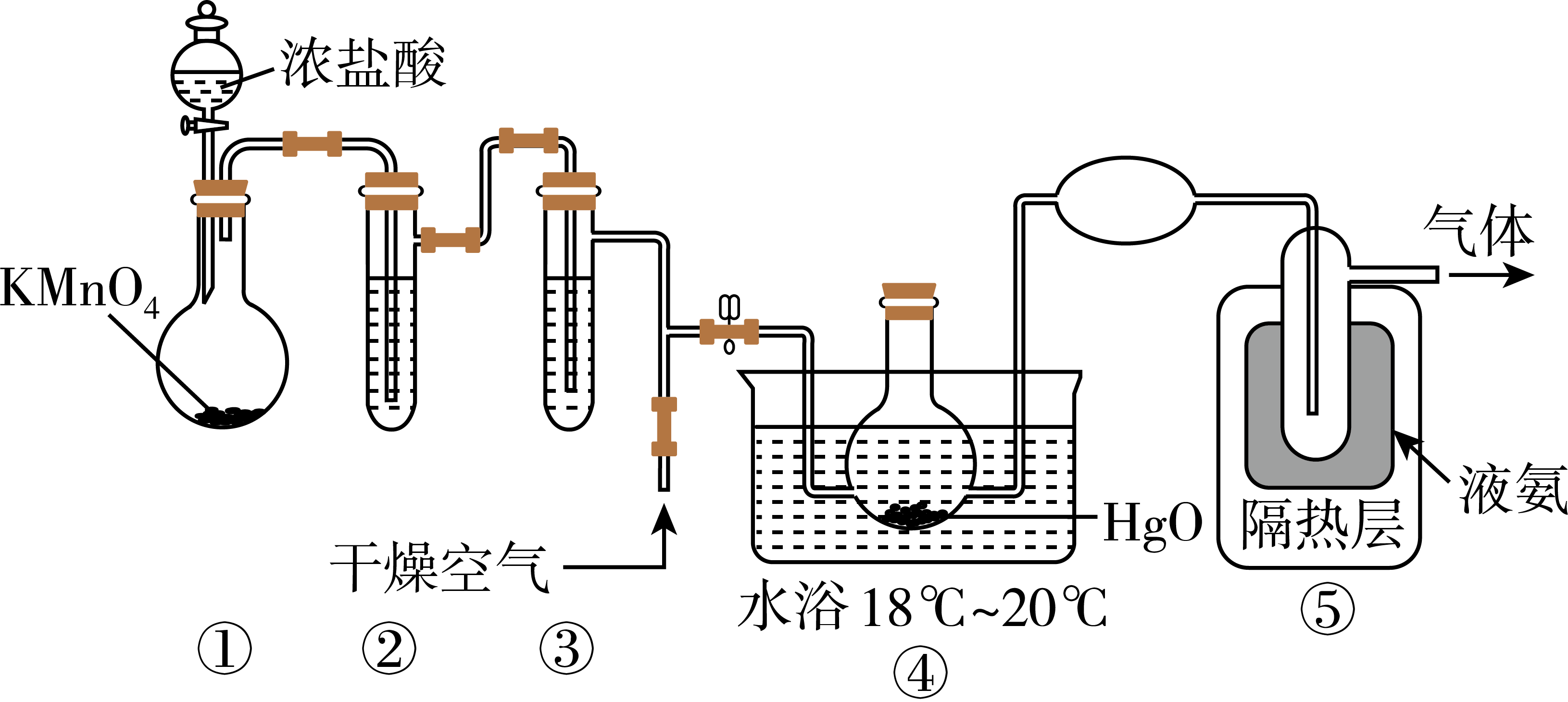
已知:①Cl2O的熔点为-116℃、沸点为3.8℃,具有强烈刺激性气味、易溶于水;
②Cl2O与有机物、还原剂接触或加热时会发生燃烧并爆炸。
下列说法中正确的是( )
A、装置③中盛装的试剂是饱和食盐水 B、装置④与⑤之间可用橡胶管连接 C、从装置⑤中逸出气体的主要成分是Cl2O D、通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险 -
5、钒是一种熔点高、硬度大、无磁性的金属,广泛应用于钢铁、航空航天、能源等领域。工业上利用冶炼铝生成的固体废料——赤泥(主要成分为Fe2O3、Al2O3、V2O5及少量稀土金属氧化物)提取金属钒,其工艺流程图如下:

已知:钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,且存在平衡VO2++H2OVO3-+2H+。下列说法正确的是( )
A、工业生产中,碱浸步骤可选用较为廉价的氨水 B、可以推测VO2Cl溶解度大于NH4VO3 C、焙烧非磁性产品所得的固体产物加酸溶解时,应加入过量盐酸使其溶解完全 D、将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,则磁性产品中一定不含铁元素 -
6、某同学欲验证Fe3+和I-在水溶液中发生可逆反应:2Fe3++2I-=2Fe2 ++I2 , 设计了下列实验操作,并给出了预测现象,其中不必要的实验操作是(不考虑水中溶解的少量氧气的影响)( )
实验操作
预测现象
A
在9 mL0.1 mol•L -1 KI溶液中滴加几滴FeCl3溶液,振荡,将溶液分为三等份
溶液颜色发生变化
B
往第一份溶液中滴加淀粉试液,振荡
溶液变蓝色
C
往第二份溶液中滴加几滴AgNO3溶液,振荡
有黄色沉淀产生
D
往第三份溶液中滴加几滴KSCN溶液,振荡
溶液变红色
A、A B、B C、C D、D -
7、X、Y、Z、W是原子序数依次增大的位于两个短周期主族元素,Y、W原子核外未成对电子数相同,Z与X的简单化合物很容易液化,X、Z核外最外层电子数之和等于W核外最外层电子数。四种元素能组成一种治疗痛风症的药物M,M的结构简式如图所示。下列说法正确的是( )
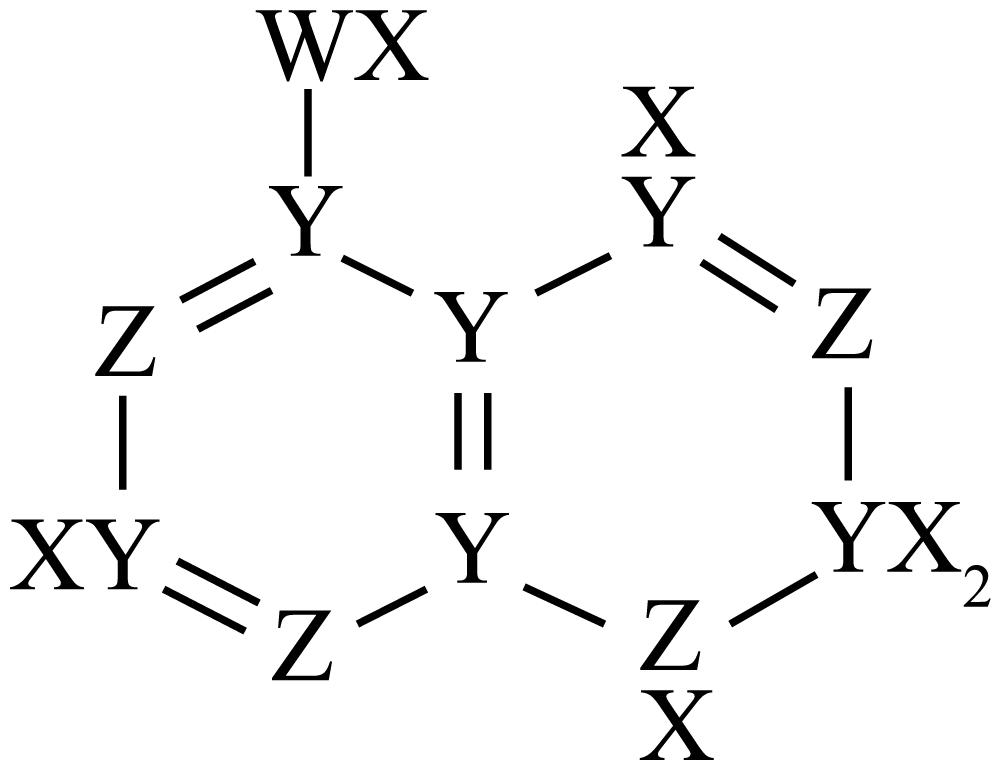 A、元素的第一电离能:W>Z>Y B、X、Z、W三种元素形成的化合物只能是共价化合物 C、M分子中,X、Y、Z、W四种原子均满足8电子稳定结构 D、Y与X,W形成的化合物有可能使酸性高锰酸钾溶液褪色
A、元素的第一电离能:W>Z>Y B、X、Z、W三种元素形成的化合物只能是共价化合物 C、M分子中,X、Y、Z、W四种原子均满足8电子稳定结构 D、Y与X,W形成的化合物有可能使酸性高锰酸钾溶液褪色 -
8、工业烟气中含有较高浓度的氮氧化物,需进行脱除处理才能排放到大气中。下图是一种利用NH3在催化剂条件下脱除NO的原理示意图:

下列说法错误的是( )
A、步骤①中NO发生氧化反应 B、步骤②中包含有σ键和π键的断裂 C、若参与反应的NO和NH3的物质的量相等,则总反应化学方程式为4NH3+4NO+O24N2+6H2O D、当消耗和时,消耗NO的物质的量为 -
9、向含a mol NaClO的溶液通入b mol SO2充分反应(不考虑二氧化硫与水之间的反应以及次氯酸的分解)。下列说法不正确的是( )A、当0<b< 时:SO2+H2O+3ClO-= +2HClO+Cl- B、当b=a时:SO2+H2O+ClO-=+2H++Cl- C、当 <b<a时;反应后溶液中H+的物质的量:0<n(H+)<2bmol D、当0<b<a时;反应后溶液中Cl-、ClO-和物质的量之比为:(a-b):b:b
-
10、在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是( )A、Fe2+++Ba2++2OH-═BaSO4↓+Fe(OH)2↓ B、+Fe3+++Ba2++4OH-═BaSO4↓+Fe(OH)3↓+NH3•H2O C、2Fe3++3+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ D、3+Fe3++3+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3•H2O
-
11、常温下,下列各组离子在给定溶液中可能大量共存的是( )A、麦芽糖溶液中:、、、 B、能使苯酚溶液显紫色的溶液中:、、、 C、水电离出来的的溶液中:、、、 D、滴加甲基橙显红色的水溶液中:、、、
-
12、某些物质之间可以在一定条件下进行如下转化,下列说法正确的是( )
 A、若A、B、C含同种金属元素,则a可能是NaOH溶液,也可能是氨水 B、若a为 , 则A可以为NH3 C、若a为 , 则A、B、C可以为NaClO、、 D、若a为 , A为乙醇,B为乙醛,则C一定是乙酸
A、若A、B、C含同种金属元素,则a可能是NaOH溶液,也可能是氨水 B、若a为 , 则A可以为NH3 C、若a为 , 则A、B、C可以为NaClO、、 D、若a为 , A为乙醇,B为乙醛,则C一定是乙酸 -
13、我国古代四大发明之一黑火药的爆炸反应为。设为阿伏加德罗常数的值,下列说法正确的是( )A、含键数目为 B、晶体中含离子数目为 C、每生成转移电子数目为 D、溶液中含数目为
-
14、化学与科技、生产、生活密切相关,下列说法错误的是( )A、有机硅橡胶具有弹性大的特点,是一种良好的防振体,有机硅橡胶是纯净物 B、2023年5月成功发射的天舟六号货运飞船的推进剂可用液态肼 C、卡塔尔AI Janoub体育场屋顶采用的聚四氟乙烯板材属于有机高分子材料 D、碳纳米材料是新型无机非金属材料,主要包括富勒烯、碳纳米管、石墨烯等
-
15、现有一种铜粉和铝粉的混合物样品,为测定该样品中铝的含量,称取5.0g此样品置于锥形瓶中,将100mL稀盐酸加入其中恰好完全反应,剩余固体2.3g。(1)、求该混合物中铝的质量分数为多少?(2)、所用盐酸中溶质的物质的量浓度为多少?
-
16、乙酸乙酯是一种有香味的油状液体,在一定条件下发生反应:CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O(1)、乙酸乙酯的分子式是。(2)、写出乙醇与金属Na反应的化学方程式。(3)、写出乙酸的一种用途。(4)、乙醇与氧气的反应方程式为。设计成原电池时,乙醇作(填“正极”或“负极”)。
-
17、下面是元素周期表的一部分,表中的每个字母表示一种短周期元素,请回答下列问题:
 (1)、D在元素周期表中的位置是第三周期族。(2)、A、E两种元素所形成的气态氢化物较稳定的是(填化学式)。(3)、B、C两元素的原子半径较小的是(填元素符号)。(4)、在盛有水的小烧杯中加入元素B的单质,发生反应的化学方程式为:。(5)、非金属性最强的元素是(元素符号)。
(1)、D在元素周期表中的位置是第三周期族。(2)、A、E两种元素所形成的气态氢化物较稳定的是(填化学式)。(3)、B、C两元素的原子半径较小的是(填元素符号)。(4)、在盛有水的小烧杯中加入元素B的单质,发生反应的化学方程式为:。(5)、非金属性最强的元素是(元素符号)。 -
18、下列关于硫酸的说法,正确的是( )A、浓硫酸有氧化性,稀硫酸没有氧化性 B、浓硫酸与碳反应时,浓硫酸既表现氧化性又表现酸性 C、将铝片分别投入常温下的浓硫酸和稀硫酸,快速放出气体的是稀硫酸 D、浓硫酸使胆矾晶体由蓝色变为白色体现了脱水性
-
19、关于铁的三种氧化物(FeO、Fe2O3、Fe3O4)的下列叙述正确的是( )A、铁的三种氧化物中铁元素的化合价完全相同 B、都是碱性氧化物,都能与盐酸反应生成氯化铁和水 C、氧化亚铁可应用于瓷器制作中使釉呈绿色 D、四氧化三铁中铁元素有+2价和+3价,它是一种混合物
-
20、下列说法不正确的是( )A、用银氨溶液可以鉴别葡萄糖和乙酸溶液 B、肥皂的主要成分是高级脂肪酸 C、植物油的主要成分是不饱和高级脂肪酸甘油酯 D、淀粉遇碘酒变蓝色,葡萄糖能与新制悬浊液发生反应