-
1、X、Y、Z、M、N属于周期表短周期主族元素,且原子序数依次增大。元素X的基态原子中所含3个能级的电子数均相等,元素Z的基态原子中2p能级上成单电子数与X相同,M与X同主族,元素N的基态原子只含有1个未成对电子。下列说法正确的是( )A、原子半径:r(X)<r(M)<r(N) B、XZ2和MZ2的晶体类型相同 C、第一电离能:I1(X)<I1(Z)<I1(Y) D、最高价氧化物对应水化物的酸性:N<M
-
2、下列有关实验装置进行的相应实验,能达到实验目的的是( )
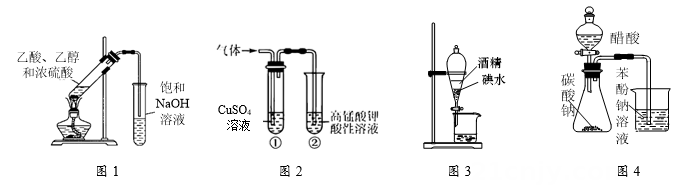 A、用图1装置制备乙酸乙酯 B、用图2检验电石与水反应产生的乙炔 C、用图3装置用酒精萃取碘水中的碘 D、用图4验证酸性:醋酸>碳酸>苯酚
A、用图1装置制备乙酸乙酯 B、用图2检验电石与水反应产生的乙炔 C、用图3装置用酒精萃取碘水中的碘 D、用图4验证酸性:醋酸>碳酸>苯酚 -
3、在给定条件下,下列选项中所示物质间的转化均能实现的是( )A、
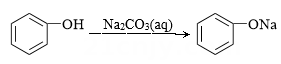 B、
B、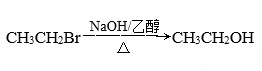 C、
C、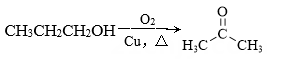 D、
D、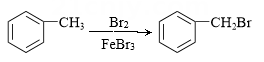
-
4、下列变化中,由加成反应引起的是( )A、乙醇滴入酸性高锰酸钾溶液中,酸性高锰酸钾溶液褪色 B、甲烷与氯气混合后,在光照条件下,黄绿色逐渐消失 C、在催化剂存在下,苯与液溴反应生成溴苯 D、乙炔通入溴的四氯化碳溶液中,溴的四氯化碳溶液褪色
-
5、下列说法正确的是( )A、图为质谱图
 B、
B、 的命名:2-甲基丁烷
C、乙烯的结构简式为CH2CH2
D、NH3的VSEPR模型为
的命名:2-甲基丁烷
C、乙烯的结构简式为CH2CH2
D、NH3的VSEPR模型为 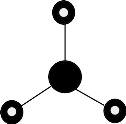
-
6、铁及其化合物在处理工业废水、废气过程中发挥着重要作用。
 (1)、用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2+HS- =2[Fe(CN)6]4-+ 2+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为;电解过程中阴极区溶液的pH(填“变大”、 “变小”或“不变")。(2)、以铁为电极电解除铬,如图2
(1)、用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2+HS- =2[Fe(CN)6]4-+ 2+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为;电解过程中阴极区溶液的pH(填“变大”、 “变小”或“不变")。(2)、以铁为电极电解除铬,如图2已知:+ H2O=2+2H+
氧化性:>
①电解过程中主要反应之一:+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是。
②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是。
 (3)、高铁酸钾(K2FeO4)除锰
(3)、高铁酸钾(K2FeO4)除锰已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式。
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是。
-
7、室温下,某一元弱酸HA的电离常数.向20.00mL浓度约为HA溶液中逐滴加入的标准NaOH溶液,(1)、滴定过程中部分操作如下,下列各操作使测量结果偏高的是____(填字母序号).A、滴定前碱式滴定管未用标准NaOH溶液润洗 B、用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定 C、滴定过程中,溶液出现变色后,立即停止滴定 D、滴定结束后,仰视液面,读取NaOH溶液体积(2)、若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为mol/L.(保留4位有效数字)
实验序号
NaOH溶液体积/mL
待测HA溶液体积/mL
1
21.01
20.00
2
20.99
20.00
3
21.60
20.00
(3)、25℃时,有关物质的电离平衡常数如下表所示:化学式
电离平衡常数()
①等浓度的、、结合的能力由强到弱的顺序为:.
②将过量气体通入溶液中的离子反应方程式为:.
(4)、已知草酸为二元弱酸: , , 常温下,向某浓度的溶液中逐滴加入一定浓度的KOH溶液,所得溶液中、、三种微粒的物质的量分数()与溶液pH的关系如图所示.则时,溶液中.
-
8、回答下列问题:(1)、某温度下在容积为2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是。
②4min时,υ正υ逆(填“>”“<”或“=")。
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经相同时间后,测得三个容器中的反应速率分别为甲:υ(X)=0.3mol·L-1·s-1 , 乙:υ(Y)=0.12mol·L-1·s-1 , 丙:υ(Z)=9.6mol·L-1·min-1.则甲、乙、丙三个容器中反应速率由快到慢的顺序为。
④下列措施能增大该反应速率的是(选填字母)
A.升高温度 B.恒容条件下充入Ar气
C.减小Z的浓度 D.将反应容器体积缩小
(2)、反应2NO(g)+O2(g)⇌2NO2(g),在一定温度下密闭容器内,能说明该反应已经达到化学平衡状态的是。a.2υ逆(NO)=υ正(O2)
b.容器内压强保持不变
c.υ(NO2)=2υ(O2)
d.容器内的密度保持不变
e.容器内混合气体平均相对分子质量不变
f.c(NO):c(O2):c(NO2)=2:1:2
g.容器内气体颜色不变
(3)、常见的烟道气中除去SO2的方法之一:2CO(g)+SO2(g)⇌2CO2(g)+S(l) (ΔH<0),该反应的平衡常数表达式为。若在2L的密闭容器中进行上述反应,经测定在5min内气体的质量减少了1.6g,则0~5min的平均反应速率υ(SO2)=。 -
9、“碳达峰”“碳中和”“低碳”成为网络热词,其相关内容是二氧化碳导致的温室效应。二氧化碳的转化和利用成为一个重要的研究课题。回答下列问题:(1)、乙烯是一种重要的化工原料,利用和为原料可生产乙烯。已知相关热化学方程式如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
①反应Ⅳ: 。
②在某种催化剂的作用下,在容积为2.0L的恒容密闭容器中充入和 , 体系中主要发生上述反应Ⅰ和反应Ⅳ两个竞争反应。反应进行时测得两种烃的物质的量随温度的变化如下图所示,该催化剂在840℃时主要选择(填“反应Ⅰ”或“反应Ⅳ”);520℃时,内用氢气表示反应Ⅳ的平均反应速率(用含t的代数式表示)。
 (2)、多聚胺[
(2)、多聚胺[ ]可捕捉环境中的 , 然后将其转化为甲醇,反应机理如下图所示:
]可捕捉环境中的 , 然后将其转化为甲醇,反应机理如下图所示:
该反应机理中,多聚胺的作用是 , 该反应机理的总反应的化学方程式是。
(3)、碳酸二甲酯(DMC)为一种非常重要的有机化工原料,华东理工大学以镁粉为催化剂,通过甲醇与反应成功制备了DMC:。①上述反应达到平衡时,其他条件不变,向恒压密闭容器中充入少量 , 甲醇的平衡转化率(填“增大”“减小”或“不变”)。
②温度为TK,按投料比向恒容密闭容器中投料,平衡前后气体的压强之比为6:5,测得平衡体系中气体的压强为 , 则TK时该反应的压强平衡常数(以分压表示,分压=总压×物质的量分数)。
-
10、中国科学家在淀粉人工光合成方面取得重大突破性进展,该实验方法首先将CO2催化还原为CH3OH。已知CO2催化加氢的主要反应有:
①CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=-49.4kJ•mol-1
②CO2(g)+H2(g)CO(g)+H2O(g) △H2=+41.2kJ•mol-1
其他条件不变,在相同时间内温度对CO2催化加氢的影响如图。下列说法不正确的是( )

已知:CH3OH的选择性=×100%
A、增大有利于提高CO2的平衡转化率 B、使用催化剂,能降低反应的活化能,增大活化分子百分数 C、其他条件不变,增大压强,有利于反应向生成CH3OH的方向进行 D、220~240℃,升高温度,对反应②速率的影响比对反应①的小 -
11、资源化利用是实现“碳中和”的重要途径,与氢气反应制的一种催化机理如图所示,总反应为>0,下列说法正确的是( )
 A、过程Ⅲ中,没有化学键断裂 B、在Ni催化作用下产生·H为吸热过程 C、反应中释放出 D、总反应中,反应物的键能之和小于生成物的键能之和
A、过程Ⅲ中,没有化学键断裂 B、在Ni催化作用下产生·H为吸热过程 C、反应中释放出 D、总反应中,反应物的键能之和小于生成物的键能之和 -
12、25 ℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与lg X的变化关系如图所示。已知:lg X=lg或lg , 下列叙述正确的是( )
 A、曲线m表示pH与lg的变化关系 B、当溶液呈中性时,c(Na+)=c()+2c() C、Ka1(H2CO3)的数量级为10-6 D、滴加过程中,保持不变
A、曲线m表示pH与lg的变化关系 B、当溶液呈中性时,c(Na+)=c()+2c() C、Ka1(H2CO3)的数量级为10-6 D、滴加过程中,保持不变 -
13、750℃时,NH3和O2发生以下两个反应:
①4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H1
②4NH3(g)+3O2(g)2N2(g)+6H2O(g) △H2
下列说法正确的是( )
A、反应①的平衡常数可表示为K1= B、反应②的△S<0 C、反应①中每生成2molNO,转移电子数约为6.02×1024 D、反应②的△H2=2E(N≡N)+12E(H-O)-12E(N-H)-3E(O=O) -
14、下列装置或操作能达到目的的是( )




A.排出酸式滴定管中的气泡
B.灼烧海带
C.比较CH3COOH的Ka和H2CO3的Ka1大小
D.测定氯水的pH
A、A B、B C、C D、D -
15、已知常温下,几种物质的电离平衡常数,下列说法正确的是( )
弱酸
HCOOH(甲酸)
HClO
K(25℃)
A、向NaClO溶液中通入足量SO2能提高次氯酸的浓度 B、向HCOONa(甲酸钠)溶液中滴加过量CO2: C、向Na2CO3溶液中通入过量Cl2: D、向NaClO溶液中通入少量CO2: -
16、某化学小组同学研究温度和压强对反应速率和化学平衡的影响,测得化学反应中C的百分含量(C%)与时间(t)、温度(T)、压强(p)的关系如图所示。下列说法正确的是( )
 A、、 B、、 C、、 D、、
A、、 B、、 C、、 D、、 -
17、下列装置能达到设计目的的是( )




①
②
③
④
A、装置①用于深埋在潮湿的中性土壤中钢管的防腐 B、装置②用于深浸在海水中的钢闸门的防腐 C、装置③用于模拟铁制品表面镀铜 D、装置④用于构成锌铜原电池 -
18、已知反应: , 其他相关数据如下表:
化学键
1化学键断裂时吸收的能量/
x
498
803
464
下列说法正确的是( )
A、反应物的总能量小于生成物的总能量 B、的燃烧热是806.0 C、 D、断开氧氧键形成1氧原子需要放出能量249 -
19、化学电源在日常生活和高科技领域中都有广泛应用。下列说法错误的是( )
 A、甲:反应时盐桥中的阳离子移向溶液 B、乙:正极的电极反应式为 C、丙:锌筒作负极,发生氧化反应,锌筒会变薄 D、丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
A、甲:反应时盐桥中的阳离子移向溶液 B、乙:正极的电极反应式为 C、丙:锌筒作负极,发生氧化反应,锌筒会变薄 D、丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降 -
20、已知强酸强碱的稀溶液发生中和反应时,生成放热 , 若用与的稀溶液反应,每完全中和时放热 , 下列说法正确的是( )A、是一种强酸 B、浓硫酸与反应生成时放热为 C、表示与中和反应的热化学方程式为: D、电离的热化学方程式为: