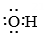-
1、按图所示装置(部分夹持装置略)检验浓硫酸与木炭反应的产物。下列说法正确的是( )
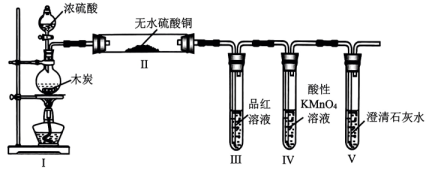 A、Ⅰ中烧瓶内的反应体现了浓硫酸的酸性和强氧化性 B、Ⅱ中无水硫酸铜可替换为无水 C、Ⅲ中溶液褪色,证明产物中有 D、Ⅳ中溶液褪色且Ⅴ中产生沉淀,证明产物中一定有
A、Ⅰ中烧瓶内的反应体现了浓硫酸的酸性和强氧化性 B、Ⅱ中无水硫酸铜可替换为无水 C、Ⅲ中溶液褪色,证明产物中有 D、Ⅳ中溶液褪色且Ⅴ中产生沉淀,证明产物中一定有 -
2、化学处处呈现美。下列说法不正确的是( )A、金刚石中的碳原子采取杂化轨道形成空间网状结构 B、溶液与溶液反应生成蓝色沉淀 C、缺角的NaCl晶体在饱和NaCl溶液中变为完美立方体块,体现晶体的自范性 D、绚烂烟花的产生是电子由基态跃迁到激发态时,能量以光的形式释放引起的
-
3、我国科学家设计了水/有机混合高能锂硫电池,其工作原理如图所示。下列说法正确的是( )
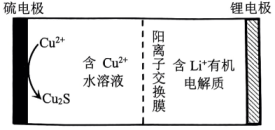 A、硫电极为负极 B、通过阳离子交换膜向锂电极方向迁移 C、硫电极上发生的反应为 D、理论上,每消耗1molS,同时消耗2molLi
A、硫电极为负极 B、通过阳离子交换膜向锂电极方向迁移 C、硫电极上发生的反应为 D、理论上,每消耗1molS,同时消耗2molLi -
4、利用“氧氯化法”以乙烯为原料制备氯乙烯过程中的物质转化关系如图所示。下列说法不正确的是( )
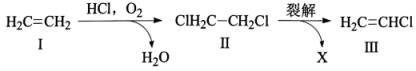 A、化合物Ⅰ分子中所有原子共平面 B、化合物Ⅱ与NaOH的乙醇溶液反应可得到化合物Ⅰ C、裂解时,另一产物X为HCl D、化合物Ⅲ发生加聚反应的产物为
A、化合物Ⅰ分子中所有原子共平面 B、化合物Ⅱ与NaOH的乙醇溶液反应可得到化合物Ⅰ C、裂解时,另一产物X为HCl D、化合物Ⅲ发生加聚反应的产物为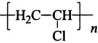
-
5、丰富多彩的校本课程为学生提供了劳动实践的机会。课程中所涉及的劳动实践与化学知识没有关联的是( )
选项
劳动实践
化学知识
A
烘焙糕点:加入小苏打做膨松剂
固体溶于水吸热
B
酿葡萄酒:向葡萄汁中添加适量的
具有杀菌和抗氧化作用
C
种植瓜果:施肥时,将碳酸氢铵埋入土壤中
受热易分解
D
自制肥皂:向植物油中加入NaOH溶液
油脂在碱性条件下水解
A、A B、B C、C D、D -
6、利用如图所示装置实现的制备、检验及氨水的制备。下列相关说法不正确的是( )
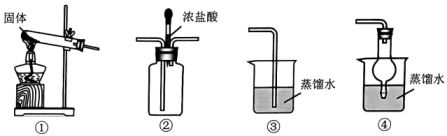 A、①中固体为 B、将制得的通入②中,滴入浓盐酸后,②中产生大量白烟 C、为得到氨水,应选择④作为氨气的吸收装置 D、向溶液中滴加氨水至过量,可生成
A、①中固体为 B、将制得的通入②中,滴入浓盐酸后,②中产生大量白烟 C、为得到氨水,应选择④作为氨气的吸收装置 D、向溶液中滴加氨水至过量,可生成 -
7、走进美丽广东,体会文化魅力。下列有关说法不正确的是( )A、粤绣所用“金银线”中含有的醋酸纤维素,属于有机高分子材料 B、加热牛奶和蛋清混合物制作双皮奶,该过程涉及蛋白质的变性 C、岭南古建筑采用青砖黛瓦风格,青砖中青色来自氧化铁 D、航海船舶的外壳安装锌块,利用了牺牲阳极法的防腐原理
-
8、2023年,我国科技事业收获丰硕成果。下列与科技成就相关的描述正确的是( )A、打造北斗卫星系统——与星载铷钟所用的物理性质不同 B、实施海底封存——液化时,其共价键被破坏 C、开启航运氢能时代——氢氧燃料电池工作时可将热能转化为电能 D、突破量子通信技术——作为传输介质的光纤,其主要成分为晶体硅
-
9、传承中华瑰宝,发扬戏曲文化。下列戏曲表演用品主要由无机非金属材料制成的是( )




A.商周傩戏使用的青铜面具
B.战国礼乐使用的青瓷甬钟
C.宋元杂剧使用的缂丝团扇
D.清皮影戏使用的牛皮人偶
A、A B、B C、C D、D -
10、柠檬酸亚铁(FeC6H6O7)是一种易被人体吸收的高效铁制剂, 医疗上可以用来治疗缺铁性贫血。某课题组以硫铁矿烧渣(含 Fe2O3、SiO2、少量Al2O3等)为原料,先制备碳酸亚铁,再与柠檬酸反应可以制得柠檬酸亚铁。其工艺流程如下:

已知:调节溶液的pH可以使水溶液中的金属离子形成氢氧化物沉淀,下表为相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
金属离子
Al3+
Fe2+
Fe3+
沉淀开始pH
3.1
5.9
1.2
沉淀完全 pH
5.1
6.9
3.2
(1)、基态Fe价电子排布式为。Si处于元素周期表的区。(2)、“浸泡”时加入过量硫酸的目的:。(3)、“除杂”时有同学提出下列两种途径,途径一:
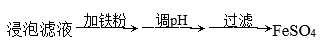
途径二:
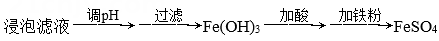
①请选择较合理的途径并说明理由。
②“加铁粉”时发生主要反应的离子方程式。
(4)、“制备FeCO3”时,Na2CO3溶液的浓度对沉淀中铁元素的质量分数以及FeCO3产率的影响如图:
Na2CO3溶液的浓度大于 4 mol/L时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是。
(5)、已知柠檬酸亚铁易被氧化,能溶于水,不溶于乙醇。设计试验方案,从“制备FeCO3”中得到的FeCO3制备柠檬酸亚铁晶体: , 静置、过滤、洗涤、干燥, 获得柠檬酸亚铁晶体。(必须用到的试剂有:Fe粉、柠檬酸溶液、无水乙醇) -
11、本维莫德(G)是治疗湿疹的非激素类外用药,其合成路线如下:
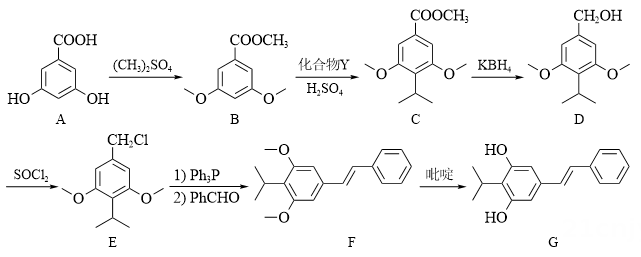
其中,-Ph为苯基(
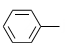 , 即苯失去一个H得到的原子团 )。(1)、室温下,在水中A的溶解度比B的(填“大”或“小”或“无差别”)。(2)、A→B的主要目的为。(3)、Y的分子式为C3H8O,其结构简式为。(4)、B→C的反应类型为。(5)、B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式。
, 即苯失去一个H得到的原子团 )。(1)、室温下,在水中A的溶解度比B的(填“大”或“小”或“无差别”)。(2)、A→B的主要目的为。(3)、Y的分子式为C3H8O,其结构简式为。(4)、B→C的反应类型为。(5)、B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式。碱性条件下水解后酸化生成两种产物。一种产物含有苯环,其核磁共振氢谱只有2组峰;另一种产物能与银氨溶液反应,被氧化为碳酸后分解生成二氧化碳和水。
(6)、写出以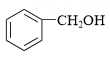 为原料制备
为原料制备 的合成路线流程图(须用Ph3P,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(须用Ph3P,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 -
12、ClO2是一种安全稳定、高效低毒的广谱型消毒剂,它易溶于水、难溶于有机溶剂,高浓度的ClO2气体易爆炸。常见制备ClO2的方法如下:(1)、Ⅰ.利用NaClO2与纯净的Cl2反应可制得ClO2和NaCl,实验装置如图所示(夹持装置略)。
装置B中试剂为。 (2)、装置E中所盛试剂是CCl4 , 其作用为。(3)、Ⅱ.草酸(H2C2O4)、氯酸钾和适当浓度的H2SO4溶液反应制取ClO2 , 反应的化学方程式为
(2)、装置E中所盛试剂是CCl4 , 其作用为。(3)、Ⅱ.草酸(H2C2O4)、氯酸钾和适当浓度的H2SO4溶液反应制取ClO2 , 反应的化学方程式为2KClO3+H2C2O4 = K2CO3+CO2↑+2ClO2↑+H2O。
该方法制备ClO2的优点是。
(4)、Ⅲ.以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2 , 再用水吸收获得ClO2溶液。在ClO2的制备和吸收过程中均需要控制适宜的温度,如图所示为温度对ClO2纯度、吸收率的影响。
已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42- , 写出该法制备ClO2
气体的离子方程式: , 由图可知,反应时采取的适宜措施是。
(5)、某校化学学习小组拟以“”作为衡量ClO2产率的指标。取NaClO3样品质量6.750 g,通过反应和吸收可得400.00 mL ClO2溶液,取出20.00 mL,加入37 mL 0.5000 mol·L-1 (NH4)2Fe(SO4)2溶液充分反应,过量Fe2+再用0.05000 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:4H++ ClO2 + 5Fe2+= Cl-+ 5Fe3++ 2H2O;
H++ Fe2++ Cr2O―― Cr3++ Fe3++ H2O (未配平),试计算ClO2的产率
-
13、(1)、已知。
①
 的酮羰基相邻碳原子上的C-H键极性强,易断裂,原因是。
的酮羰基相邻碳原子上的C-H键极性强,易断裂,原因是。②该条件下还可能生成一种副产物,与B互为同分异构体。该副产物的结构简式是。
(2)、已知:C2H5OH(g) = C2H5OH(1) △H1=-Q1 kJ·mol-1C2H5OH(g)+3O2(g) = 2CO2(g)+3H2O(g) △H2=-Q2 kJ·mol-1
H2O(g) = H2O(l) △H3=-Q3 kJ·mol-1
则C2H5OH(l)+3O2(g) = 2CO2(g)+3H2O(l) △H=kJ·mol-1(用含有Q1、Q2、Q3的式子表示),若将23 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为kJ。
(3)、①Cu与N两种元素组成的化合物具有良好光学性能。其晶胞结构如图所示。该物质的化学式为。

②CuBr2的水溶液呈蓝色,蓝色物质为水合铜离子,可表示为 [Cu(H2O)4]2+ , 1 mol [Cu(H2O)4]2+含有σ键的数目为。[Cu(H2O)4]2+的结构式可表示为。
-
14、下列实验探究方案能达到探究目的的是( )
探究方案
探究目的
A
将卤代烃与NaOH溶液加热,冷却后,向体系中加稀硝酸调节至酸性,滴加硝酸银溶液,观察沉淀颜色
确定卤代烃中卤素原子种类
B
取4 mL乙醇,加入12 mL浓硫酸及少量沸石,迅速升温至170℃,将产生的气体通入酸性高锰酸钾溶液,观察溶液颜色变化
验证乙醇发生消去反应
C
向1 mL 0.1 mol·L-1 NaOH溶液中加入2 mL 0.1 mol·L-1 CuSO4溶液,振荡后滴加0.5 mL有机物X,加热,观察是否产生砖红色沉淀
确定X中是否含有醛基结构
D
向Fe(NO3)2溶液中滴加硫酸酸化的H2O2溶液,观察溶液颜色变化
证明氧化性H2O2 > Fe3+
A、A B、B C、C D、D -
15、抗氧化剂香豆酰缬氨酸乙酯(Z)可由下列反应制得。
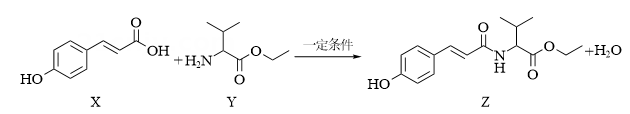
下列说法正确的( )
A、化合物Y含有的官能团为酯基和酰胺基 B、化合物X和Z可以用FeCl3溶液鉴别 C、应化合物X与足量H2反应,得到的产物含有2个手性碳原子 D、化合物Z在酸性条件下水解得到3种不同有机物 -
16、一种从工业电解精炼铜的阳极泥(含有Se、Au、Ag、CuSe、Ag2Se等)中提取硒的过程如图所示。下列说法正确的是( )
 A、Se的核外电子排式为[Ar]4s24p4 B、“焙烧”时,Ag2Se与O2反应每消耗1 mol O2 , 转移的电子总数为4 mol C、甲酸还原H2SeO3反应的化学方程式为:H2SeO3+2HCOOH=Se↓+2CO2↑+3H2O D、用得到的银可制得氯化银(晶胞如图所示),氯化银晶胞中Ag+周围最近且等距离的Ag+的数目为8
A、Se的核外电子排式为[Ar]4s24p4 B、“焙烧”时,Ag2Se与O2反应每消耗1 mol O2 , 转移的电子总数为4 mol C、甲酸还原H2SeO3反应的化学方程式为:H2SeO3+2HCOOH=Se↓+2CO2↑+3H2O D、用得到的银可制得氯化银(晶胞如图所示),氯化银晶胞中Ag+周围最近且等距离的Ag+的数目为8
-
17、下列表示或分析正确的是( )A、C2H2的燃烧热为1299.6 kJ·mol-1。乙炔燃烧的热化学方程式为C2H2(g) + O2(g) = 2CO2(g) + H2O(g) ΔH=-1299.6 kJ·mol-1 B、少量CO2通入足量苯酚钠溶液:C6H5ONa + CO2 + H2O→C6H5OH + NaHCO3 C、已知:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。用E表示键能,则:E(N≡N) + 3E(H-H)-6E(N-H)=92.4 kJ·mol-1 D、硫酸铜溶液中加入过量氨水Cu2++ 2NH3·H2O = Cu(OH)2↓+ 2NH4+
-
18、下列说法正确的是( )
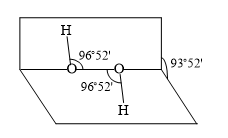 A、分子式为C9H14Cl2的有机物可能属于芳香族化合物 B、H2O2分子结构示意如图所示,H2O2为非极性分子 C、常温下,正丁烷的沸点比异丁烷的沸点低 D、相同条件下,CF3COOH溶液的酸性比CHCl2COOH溶液的酸性强
A、分子式为C9H14Cl2的有机物可能属于芳香族化合物 B、H2O2分子结构示意如图所示,H2O2为非极性分子 C、常温下,正丁烷的沸点比异丁烷的沸点低 D、相同条件下,CF3COOH溶液的酸性比CHCl2COOH溶液的酸性强 -
19、阅读下列材料,回答问题:阿司匹林是一种合成药物,化学名称为乙酰水杨酸,具有解热镇痛作用。人体血液的pH范围为7.35~7.45,长期大量服用阿司匹林会引发酸中毒,可静脉滴注NaHCO3溶液进行缓解。阿司匹林的发现源于柳树皮中含有的一种物质——水杨酸,阿司匹林以水杨酸为原料进行生产,反应如下:
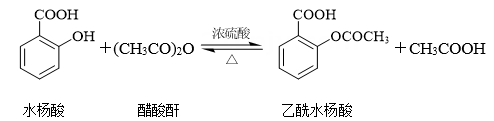
用乙二醇将乙酰水杨酸与聚甲基丙烯酸(
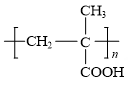 )连接起来,可得到缓释阿司匹林,
)连接起来,可得到缓释阿司匹林,其结构如下:
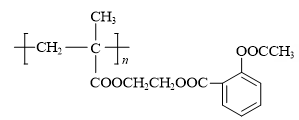 (1)、下列关于水杨酸与乙酰水杨酸的说法不正确的是( )A、1 mol水杨酸与足量的Na反应可产生1 mol H2 B、1mol乙酰水杨酸与足量NaOH溶液反应最多可消耗2 mol NaOH C、静脉滴注NaHCO3是通过调节血液的pH来达到解毒目的 D、1 mol 醋酸酐分子中含碳氧σ键数目为4 mol(2)、下列关于缓释阿司匹林制备及其性质,说法正确的是( )A、聚甲基丙烯酸能使酸性高锰酸钾溶液褪色 B、缓释阿司匹林的每个链节中含有4个碳原子 C、阿司匹林与水分子能形成氢键 D、酸性条件下,缓释阿司匹林完全水解可得到三种有机物
(1)、下列关于水杨酸与乙酰水杨酸的说法不正确的是( )A、1 mol水杨酸与足量的Na反应可产生1 mol H2 B、1mol乙酰水杨酸与足量NaOH溶液反应最多可消耗2 mol NaOH C、静脉滴注NaHCO3是通过调节血液的pH来达到解毒目的 D、1 mol 醋酸酐分子中含碳氧σ键数目为4 mol(2)、下列关于缓释阿司匹林制备及其性质,说法正确的是( )A、聚甲基丙烯酸能使酸性高锰酸钾溶液褪色 B、缓释阿司匹林的每个链节中含有4个碳原子 C、阿司匹林与水分子能形成氢键 D、酸性条件下,缓释阿司匹林完全水解可得到三种有机物 -
20、已知O2在一定条件下能有效去除烟气中的SO2、NO,可能的反应机理如题3图所示,下列说法正确的是( )
 A、SO2的键角小于120° B、和H2O中心原子的杂化方式相同 C、N的价电子轨道排布式为
A、SO2的键角小于120° B、和H2O中心原子的杂化方式相同 C、N的价电子轨道排布式为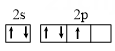 D、参与了反应,其电子式为
D、参与了反应,其电子式为