-
1、科研人员发现利用低温固体质子导体作电解质,催化合成 , 与传统的热催化合成氨相比,催化效率较高。其合成原理如图甲所示,其他条件不变,电源电压改变与生成速率的关系如图乙所示,下列说法不正确的是( )
 A、是该合成氨装置的阳极 B、电极出口混合气可能含有、、 C、若H2的进出口流量差为22.4 L/min(标准状况),则固体质子导体中的流速为1 mol/min D、当电压高于1.2V时,随电压升高,在阴极放电生成的速率加快
A、是该合成氨装置的阳极 B、电极出口混合气可能含有、、 C、若H2的进出口流量差为22.4 L/min(标准状况),则固体质子导体中的流速为1 mol/min D、当电压高于1.2V时,随电压升高,在阴极放电生成的速率加快 -
2、已知碘化氢分解吸热,分以下两步完成:2HI(g)→H2(g)+2I•(g);2I•(g)→I2(g),下列图像最符合上述反应历程的是( )A、
 B、
B、 C、
C、 D、
D、
-
3、中华优秀传统文化涉及了很多化学知识,下列有关说法错误的是( )A、《本草纲目拾遗》中对强水的记载:“性最猛烈,能蚀五金。”强水为强电解质 B、《神农本草经》中“石胆……能化铁为铜、成金银”描述的是湿法炼铜 C、刘长卿诗云“水声冰下咽,砂路雪中平”,固态冰转化为液态水为熵增的过程 D、“火树银花合,星桥铁锁开”中涉及化学能转化为热能和光能
-
4、CH3OH是一种绿色燃料,工业上制备CH3OH发生如下反应:
反应1:CO2(g) + 3H2(g)CH3OH(g) + H2O(g) ΔH1= - 49.5 kJ/mol
反应2:CO2(g) + H2(g)CO(g) + H2O(g) ΔH2= + 41.2 kJ/mol
(1)、n起始(CO2)∶n起始(H2) = 1∶3的混合气体发生反应1和反应2,恒压分别为1 MPa、3 MPa、5 MPa下反应达到平衡时CO2的转化率(α)(曲线a、b、c)以及3 MPa时生成CH3OH、CO选择性(S)的变化如图1所示(选择性为目标产物在总产物中的比率)。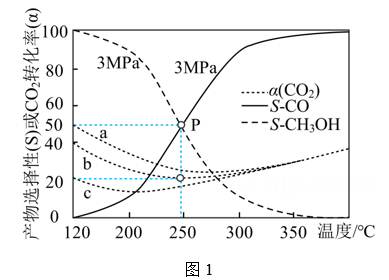
①随着温度升高,a、b、c三条曲线接近重合的原因是。
②250℃时,反应2的平衡常数K=。
(2)、恒压下,n起始(CO2)∶n起始(H2) = 1∶3的混合气体以一定流速通入分子筛膜反应器(如图2所示),反应相同时间,测得甲醇选择性随温度的变化如图3所示。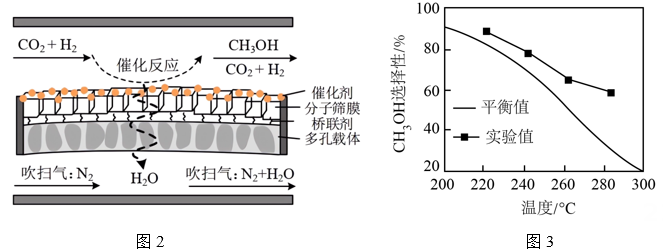
①随温度升高,平衡时CH3OH选择性降低的原因是。
②温度相同时,CH3OH选择性的实验值高于平衡值,其原因可能是。
③分子筛膜反应器可提高CO2转化率的原因是。
(3)、某甲醇燃料电池的工作原理如图4所示。负极的电极反应式为。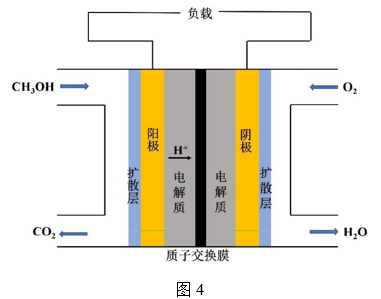
-
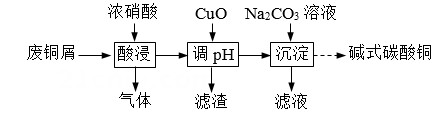
5、实验室以废铜屑(杂质为CuO、Al2O3、Fe2O3、FeO和SiO2)为原料制取碱式碳酸铜[aCu(OH)2·bCuCO3]的流程如下:
已知部分氢氧化物开始沉淀与沉淀完全的pH见下表:
物质
Fe(OH)3
Fe(OH)2
Cu(OH)2
Al(OH)3
开始沉淀pH
1.9
6.5
4.2
3.4
沉淀完全pH
3.2
9.7
6.7
4.0
(1)、按图1所示的装置加料后进行“酸浸”操作。①提高Cu元素浸出速率的方法还有。

②与使用图2所示漏斗相比,使用漏斗Y的优点是。
(2)、“调pH”的合理范围是。(3)、“沉淀”时需要对混合物加热至70℃但又不宜过高,理由是。(4)、可采用滴定法、热重分析法分别对碱式碳酸铜的组成进行分析。①滴定法涉及的部分反应:
2Cu2+ + 4I- =2CuI↓+ I2、I2 + 2Na2S2O3 = 2NaI + Na2S4O6。
请补充完整测定碱式碳酸铜中Cu元素含量的实验方案:准确称取一定质量的碱式碳酸铜样品,在搅拌下分批加入稀硫酸直至固体完全溶解,配成100mL溶液。;根据数据计算Cu元素含量(须使用的试剂:KI溶液、0.1000 mol/L Na2S2O3溶液、淀粉溶液)。
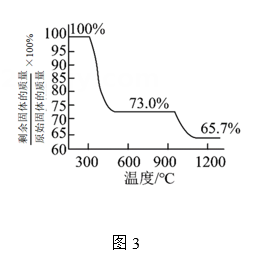
②测得碱式碳酸铜的热重分析结果如图3所示,已知当剩余固体质量与原始固体质量的比值为65.7%时固体呈砖红色,则计算可知(保留3位有效数字)。 -
6、莫西赛利(化合物E)是一种治疗脑血管疾病的药物,其合成路线如下:
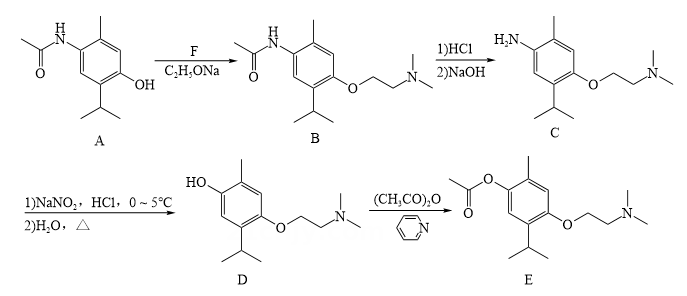 (1)、
(1)、 中N原子的杂化类型为。 (2)、D→E的反应类型为。(3)、F的分子式为C4H10ClN。A→B步骤中C2H5ONa的作用为。(4)、写出同时符合下列条件的化合物A的同分异构体的结构简式。
中N原子的杂化类型为。 (2)、D→E的反应类型为。(3)、F的分子式为C4H10ClN。A→B步骤中C2H5ONa的作用为。(4)、写出同时符合下列条件的化合物A的同分异构体的结构简式。①含有苯环的α-氨基酸;
②1H-NMR谱表明分子中共有6种不同化学环境的氢原子。
(5)、已知R-NH2易被氧化。写出以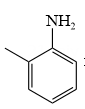 和H2C=CH2为原料合成
和H2C=CH2为原料合成 的合成线路(有机溶剂和无机试剂任选)。
的合成线路(有机溶剂和无机试剂任选)。 -
7、铈可用作优良的环保材料。现以氟碳铈矿(CeFCO3 , 含Fe2O3、FeO等杂质)为原料制备碳酸铈的工艺流程如下:
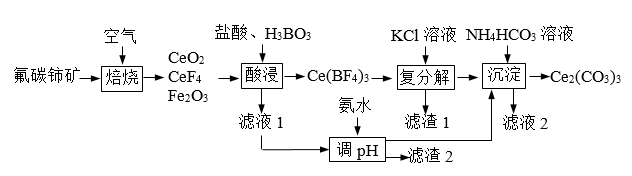 (1)、在对流空气氧化炉中比暴露在空气中“焙烧”大大缩短氧化时间的原因是。(2)、“酸浸”步骤中产生的气体为 (化学式)。(3)、“滤液1”中c(Ce3+)=0.1 mol·L-1 , 用氨水调pH的范围是(已知Ksp[Fe(OH)3] = 8×10-38;Ksp[Ce(OH)3] = 1×10-22;lg2 = 0.3,离子浓度小于1×10-5mol/L认为沉淀完全)。(4)、“沉淀”步骤中发生反应的离子方程式为。(5)、Ce2(CO3)3在空气中焙烧可制得CeO2 , 该反应的化学方程式为。(6)、用过量铝粉还原CeO2即可得Ce。铝粉必须过量的原因是:使CeO2充分被还原,提高Ce的产率;。
(1)、在对流空气氧化炉中比暴露在空气中“焙烧”大大缩短氧化时间的原因是。(2)、“酸浸”步骤中产生的气体为 (化学式)。(3)、“滤液1”中c(Ce3+)=0.1 mol·L-1 , 用氨水调pH的范围是(已知Ksp[Fe(OH)3] = 8×10-38;Ksp[Ce(OH)3] = 1×10-22;lg2 = 0.3,离子浓度小于1×10-5mol/L认为沉淀完全)。(4)、“沉淀”步骤中发生反应的离子方程式为。(5)、Ce2(CO3)3在空气中焙烧可制得CeO2 , 该反应的化学方程式为。(6)、用过量铝粉还原CeO2即可得Ce。铝粉必须过量的原因是:使CeO2充分被还原,提高Ce的产率;。 -
8、一定条件下,将一定量的CO2和H2混合气体通过装有催化剂的反应器可得到甲烷。
已知:Ⅰ.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41 kJ·mol-l
Ⅱ.CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-165 kJ·mol-1
在两种不同催化剂作用下反应相同时间,CO2转化率和生成CH4选择性随温度变化关
系如图所示(CH4选择性=×100%)。

下列说法不正确的是( )
A、反应CO(g)+3H2(g)=CH4(g)+H2O(g)的ΔH=-206 kJ·mol-1 B、在280 ℃条件下反应制取CH4 , 选择催化剂A的效果较好 C、260~300 ℃间,使用催化剂A或B,升高温度时CH4的产率都增大 D、M点可能是该温度下的平衡点,延长反应时间,不一定能提高CH4的产率 -
9、一种利用K2CO3捕集水煤气中CO2的工艺如图所示。[已知该温度下Ka1(H2CO3) = 4.6×10-7 , Ka2(H2CO3) = 5.0×10-11]。下列说法正确的是( )
 A、K2CO3溶液中:2c(K+) = c(CO32-) + c(HCO3-) + c(H2CO3) B、吸收塔中c(CO32-) :c(HCO3-)=1:2时,溶液pH=10 C、再生塔所得到的溶液中可能存在:c(H2CO3)>c(HCO3-) D、再生塔中发生反应的化学方程式:KHCO3 + KOH = K2CO3 + H2O + CO2↑
A、K2CO3溶液中:2c(K+) = c(CO32-) + c(HCO3-) + c(H2CO3) B、吸收塔中c(CO32-) :c(HCO3-)=1:2时,溶液pH=10 C、再生塔所得到的溶液中可能存在:c(H2CO3)>c(HCO3-) D、再生塔中发生反应的化学方程式:KHCO3 + KOH = K2CO3 + H2O + CO2↑ -
10、室温下,下列实验探究方案能达到探究目的的是( )
选项
实验探究方案
探究目的
A
向Fe(NO3)2和KSCN的混合溶液中滴入稀硫酸
氧化性:Fe3+>H+
B
SO2通入酸性KMnO4溶液中
SO2具有漂白性
C
向试管中加入2mL5% H2O2和1mL2%CuSO4溶液,观察气泡产生情况
Cu2+可促进H2O2分解
D
向新制氯水中加入NaHCO3固体
氯水呈酸性
A、A B、B C、C D、D -
11、科研人员通过控制光沉积的方法构建Cu2O-Pt/SiC/LrOx型复合材料光催化剂,然后以Fe2+和Fe3+离子渗透Nafion膜在酸性介质下构建了一个还原和氧化反应分离的人工光合体系,其反应机理如图。下列说法不正确的是( )
 A、该反应能量转化形式为光能→化学能 B、该人工光合体系的总反应为2CO2+2H2O2HCOOH+O2 C、图中a、b分别代表Fe3+、Fe2+ D、Cu2O-Pt上发生的反应为CO2 + 2e- + 2H+ = HCOOH
A、该反应能量转化形式为光能→化学能 B、该人工光合体系的总反应为2CO2+2H2O2HCOOH+O2 C、图中a、b分别代表Fe3+、Fe2+ D、Cu2O-Pt上发生的反应为CO2 + 2e- + 2H+ = HCOOH -
12、3-丙基-5,6-二羟基异香豆素(Y)的一步合成路线反应如图。下列有关说法正确的是( )
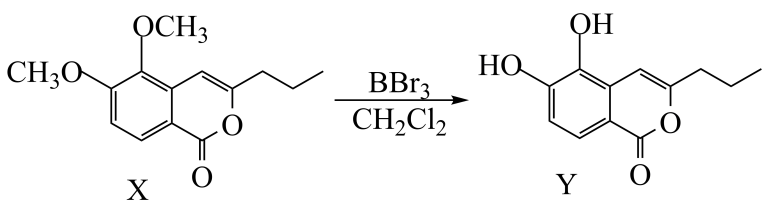 A、X中所有碳原子不可能共平面 B、Y与足量H2加成后有5个手性碳原子 C、1molY最多能与4molNaOH反应 D、1molY与浓溴水反应,最多消耗2molBr2
A、X中所有碳原子不可能共平面 B、Y与足量H2加成后有5个手性碳原子 C、1molY最多能与4molNaOH反应 D、1molY与浓溴水反应,最多消耗2molBr2 -
13、已知2NO2(g) + NaCl(s)NaNO3(s) + ClNO(g) , 下列说法正确的是( )
 A、该反应的平衡常数 B、该反应一定能自发进行 C、该反应中每消耗1molNO2 , 转移电子的数目约为3.01×1023 D、NaCl晶胞(如图所示)中每个Na+周围与其距离最近的Na+有6个
A、该反应的平衡常数 B、该反应一定能自发进行 C、该反应中每消耗1molNO2 , 转移电子的数目约为3.01×1023 D、NaCl晶胞(如图所示)中每个Na+周围与其距离最近的Na+有6个 -
14、阅读下列材料,完成问题:
周期表中ⅢA族元素(5B、13Al、31Ga、49In等)的单质及其化合物应用广泛。BF3极易水解,生成HBF4(HBF4在水中完全电离为H+和BF4-)和硼酸(H3BO3)。硼酸是一元弱酸,能溶于水,硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯[B(OCH3)3],硼酸甲酯主要用作热稳定剂、木材防腐剂等。高温下Al2O3和焦炭在氯气的氛围中获得AlCl3。GaN的结构与晶体硅类似,是第三代半导体研究的热点。铟(In)主要用于生产液晶显示器和平板屏幕。
(1)、下列说法正确的是( )A、硼酸在水溶液中的电离方程式:B(OH)3 + H2O B(OH)4- + H+ B、B(OCH3)3分子间能形成氢键 C、GaN属于分子晶体 D、In原子基态外围电子排布式为5s25p3(2)、下列化学反应表示正确的是( )A、制备B(OCH3)3: H3BO3 +3CH3OH B(OCH3)3 B、BF3水解:BF3 + 3H2O = 6H+ + 3 BF4- + BO33- C、高温下Al2O3、焦炭在氯气中反应:Al2O3 +3C +3Cl2 2 AlCl3+3CO D、用石墨作电极电解Al2O3制备Al的阳极反应式:Al3+ + 3e-=Al(3)、下列物质性质与用途具有对应关系的是( )A、BF3极易水解,可用作有机反应的催化剂 B、硼酸甲酯具有挥发性,可用作木材防腐剂 C、GaN硬度大,可用作半导体材料 D、Al2O3熔点高,可用作耐火材料 -
15、加热条件下NH3能将CuO还原成Cu,实验室制取NH3并探究其还原性,下列实验装置能达到实验目的的是( )
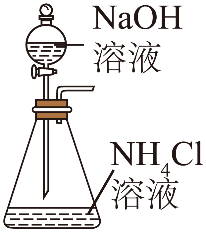
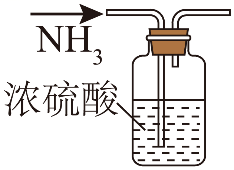
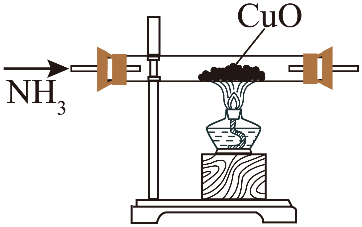
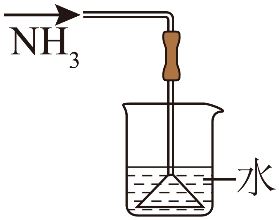
A.制取NH3
B.干燥NH3
C.验证氨气的还原性
D.吸收尾气
A、A B、B C、C D、D -
16、二氯异氰尿酸钠(结构如右图所示)是一种重要的消毒剂。下列说法正确的是( )
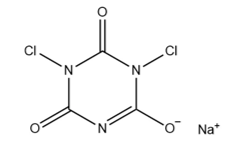 A、电负性:χ(N) > χ(O) B、键极性:C-N > C-O C、第一电离能:I1(C) > I1(N) D、离子半径:r(O2-) > r(Na+)
A、电负性:χ(N) > χ(O) B、键极性:C-N > C-O C、第一电离能:I1(C) > I1(N) D、离子半径:r(O2-) > r(Na+) -
17、H2O2是一种绿色氧化剂,可通过反应Na2O2 + H2SO4 + 10H2O = Na2SO4·10H2O + H2O2制取。下列说法正确的是( )A、Na的结构示意图为
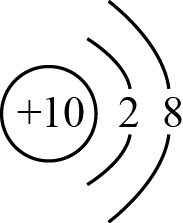 B、Na2O2既含离子键又含共价键
C、H2O2的电子式为
B、Na2O2既含离子键又含共价键
C、H2O2的电子式为  D、H2O属于非电解质
D、H2O属于非电解质
-
18、2023年9月23日,第19届杭州亚运会开幕式首次使用废碳再生的绿色甲醇作为主火炬塔燃料,实现循环内二氧化碳零排放。该措施最积极的意义在于( )A、有利于实现碳中和 B、有利于降低火炬燃料成本 C、有利于燃料充分燃烧 D、使开幕式点火场面更壮观
-
19、1841年美国学者Fremy首次合成了 , 它是一种“环境友好型氧化剂”。某小组拟制备 , 并探究其性质。已知20℃时KCl的溶解度为37.4g,的溶解度为11.1g。(1)、实验(一)制备 , 装置如图所示:
乙装置的作用是。 (2)、甲装置中副产物为氯化钾,写出生成的离子方程式: , 实验完毕后,对甲装置中混合液进行过滤、洗涤、低温干燥。(3)、实验(二)探究性质及应用。
(2)、甲装置中副产物为氯化钾,写出生成的离子方程式: , 实验完毕后,对甲装置中混合液进行过滤、洗涤、低温干燥。(3)、实验(二)探究性质及应用。取10g草酸溶于40mL水中,加入粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有 , 经测定所得气体中还含有。
实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分,当黑色固体完全反应后,测得浓硫酸质量净增bg,当等于(用最简分数比表示)时,黑色固体为。
 (4)、在其他条件相同时,测得一定浓度的稳定性(用浓度表示)与pH关系如图,其消毒效率与温度关系如图所示:
(4)、在其他条件相同时,测得一定浓度的稳定性(用浓度表示)与pH关系如图,其消毒效率与温度关系如图所示:
①根据稳定性与pH关系图得出结论是。
②在相同条件下,作消毒剂最佳温度是。
(5)、查阅资料可知,溶液呈紫红色,为探究和的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)方案1:在溶液中加过量的粉末,溶液呈紫红色。
方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。

方案(填“1”或“2”)能证明 , 石墨极的电极反应式为。
-
20、(1)、Ⅰ.页岩气中含有、、等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的和。
和在Cu/ZnO催化下发生反应可合成清洁能源甲醇: , 该反应实际上分两步进行。断开(或形成)1mol化学键的能量变化数据如下表所示,利用下表中的数据可知,该反应每生成1mol甲醇,需要(填“吸收”或“放出”)kJ的热量。
化学键
H-H
C-O
C=O
O-H
C-H
436
326
803
464
414
(2)、可利用热分解制备 , 已知下列反应的热化学方程式:①
②
③
计算热分解反应④ 。
(3)、重整技术是实现“碳中和”的一种理想的利用技术,反应为:。在pMPa时,将和按物质的量之为1:1:充入密闭容器中,分别在无催化剂及催化下反应相同时间,测得的转化率与温度的关系如图所示:在pMPa、900℃、催化条件下,将、、按物质的量之比为充入密闭容器,的平衡转化率为 , 此时平衡常数(以分压表示,分压=总压×物质的量分数;写出含、、的计算表达式)。
 (4)、Ⅱ.回收利用工业废气中的和 , 实验原理示意图如下。
(4)、Ⅱ.回收利用工业废气中的和 , 实验原理示意图如下。
①装置b中参与反应的电极为极(填“正”、“负”、“阴”或“阳”)
②反应后装置b中溶液pH变化(填“增大”、“减小”或“不变”)
③装置b中的总反应的离子方程式为。