-
1、图示为反应X=Z的能量变化图,其中X为气态化合物。下列有关叙述错误的是( )
 A、反应X=Z属于放热反应 B、反应中断裂化学键吸收的能量小于形成化学键放出的能量 C、寻找合适的电极和电解质溶液可以将X=Z反应设计成原电池 D、图示反应X=Z的能量变化为(a-c)kJ•mol-1
A、反应X=Z属于放热反应 B、反应中断裂化学键吸收的能量小于形成化学键放出的能量 C、寻找合适的电极和电解质溶液可以将X=Z反应设计成原电池 D、图示反应X=Z的能量变化为(a-c)kJ•mol-1 -
2、下列关于元素及其化合物的性质说法正确的是( )A、工业浓硝酸常因溶有少量而略显黄色 B、工业上常用软锰矿(主要成分)在加热条件下与浓盐酸反应制氯气 C、工业上采用电解熔融氯化铝的方法冶炼铝,需要添加冰晶石以提高导电能力 D、水泥、玻璃、碳化硅陶瓷、石墨烯都是新型无机非金属材料
-
3、下列实验操作中,主要不是从安全因素考虑的是( )A、点燃氢气前一定要检验氢气的纯度 B、酒精灯不用时,必须盖上灯帽 C、未使用完的白磷要随时收集起来,并与空气隔绝 D、用氢气还原氧化铜时,要先通一会儿氢气,再加热氧化铜
-
4、下列除去杂质的方法正确的是( )
选项
物质(杂质)
除杂方法
A
CO2(HCl)
将气体通过盛有饱和 Na2CO3溶液的洗气瓶
B
Cl2(HCl)
将气体通过盛有 NaOH溶液的洗气瓶
C
Mg(Al)
加入足量 NaOH 溶液后过滤、洗涤
D
CaCO3(SiO2)
加入足量盐酸后过滤、洗涤
A、A B、B C、C D、D -
5、下列关于铜、锌和稀硫酸组成的原电池的说法正确的是( )A、铜的表面没有气泡产生 B、电子从溶液中由锌向铜定向移动 C、该原电池利用电能使锌与硫酸发生反应 D、该原电池工作一段时间后,溶液中c(H+)减小
-
6、下列反应中,属于氧化还原反应但不属于四种基本反应类型的是( )A、H2+Cl22HCl B、Fe2O3+3CO2Fe+3CO2 C、Fe+2HCl=FeCl2+H2↑ D、SiO2+CaOCaSiO3
-
7、下列叙述正确的是( )A、CO2的摩尔质量为 44 g B、2gH2含有的氢原子数6.02×1023 C、标准状况下,1molH2O的体积为22.4L D、1L1mol/LKNO3溶液中含1mol K+
-
8、在含有大量Ba2+、OH-、Cl-的溶液中,还可能大量存在的离子是( )A、 B、 C、H+ D、Fe3+
-
9、下列操作方法或仪器选择正确的是( )A、
 配制一定物质的量浓度的溶液
B、
配制一定物质的量浓度的溶液
B、 分离水和乙醇
C、
分离水和乙醇
C、 收集氨气
D、
收集氨气
D、 用带玻璃塞的试剂瓶盛放NaOH溶液
用带玻璃塞的试剂瓶盛放NaOH溶液
-
10、关于核素的说法错误的是( )A、碳元素的原子序数为 6 B、碳元素的相对原子质量为14 C、该核素的中子数为 8 D、该核素用于测定一些文物的年代
-
11、化学与生活、生产密切相关,下列说法正确的是( )A、煤的气化和液化都是化学变化 B、BaSO4在医学上用作钡餐,Ba2+对人体无毒 C、铁、铝、铜在空气中长期放置表面都会生成氧化物 D、二氧化硫可广泛用于食品的增白
-
12、的捕集和利用能有效助力“碳中和”和“碳达峰”。(1)、Ⅰ.工业上常用饱和溶液回收捕集废气中的和 , 其流程为:
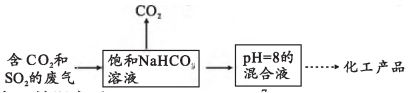
已知:该温度下,、、、。
①写出的电离平衡常数表达式。②的混合溶液中含碳微粒主要为(不考虑溶液中的分子),。
(2)、Ⅱ.工业上用与催化合成甲醇,相关反应为:
已知平衡常数、、随温度变化的曲线如图所示:相关反应
(kJ·mol)
化学平衡常数(K)
ⅰ
ⅱ
ⅲ
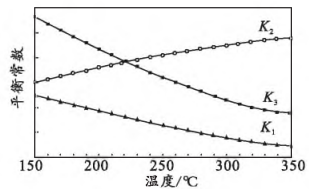
①0(填“>”或“<”),判断依据为。
②取值范围为。
(3)、一定条件下,向2 L的恒容密闭容器中充入3 mol 和1 mol 只发生反应ⅰ和ⅱ,达到平衡状态后,测得平衡时气体压强是开始的0.7倍,的转化率为80%。①平衡时mol⋅L。
②反应ii的化学平衡常数。
-
13、研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。(1)、俗称“笑气”,曾用作麻醉剂。一定温度下在某催化剂(cat)表面分解生成和 , 与催化剂面积、时间的关系如图所示:

①根据直线Ⅰ、Ⅱ可得出的结论是,其他条件相同时,。
②在Ⅱ条件下,50 min内平均分解速率为。
③若起始浓度为0.400 mol⋅L , 比较不同起始浓度时的平均分解速率:v( mol⋅L)v( mol⋅L)。(填“>”“=”或“<”)
(2)、在(Ⅲ)铁原子簇表面,反应 的反应机理如下:ⅰ.
ⅱ.
ⅲ.
ⅳ.
①O(填“>”或“<”)。
②该机理中,速率控制步骤为 , 理由是。
(3)、利用的还原性可以消除氮氧化物的污染,反应原理之一为 kJ⋅mol , 当该反应转移3 mol电子时,应放出热量kJ;已知该反应的 kJ⋅mol⋅K , 试通过计算说明该反应常温下(298K)能否自发?。 -
14、工业上利用丙烷的裂解反应制备丙烯等化工基础原料,相关反应为: kJ⋅mol。
请回答下列问题:
(1)、若该反应的正反应活化能为1076 kJ⋅mol , 则逆反应活化能为J⋅mol。(2)、若、的相对能量分别为+19 kJ⋅mol、0,则的相对能量为kJ⋅mol。(3)、利用反应反应,能用于辅助生产∘T℃时,将固定浓度的按一定流速通过有催化剂的恒容反应器,逐渐提高浓度,测得出口处、CO和浓度随初始浓度的变化关系如图所示。
能代表CO浓度的曲线是(填“甲”、“乙”或“丙”);
简述随浓度增加,甲、乙曲线“开口”越来越大的原因:。
(4)、在刚性密闭容器中充入1 mol丙烷,在催化剂作用下,相同时间内丙烯的产率与温度关系如图所示。
①在℃之前,随温度升高丙烯产率升高的原因可能是、;温度高于℃时,丙烯产率迅速降低的原因可能是、。
②某温度下,向已达平衡状态的刚性容器中再充入一定量的丙烷,再次平衡后丙烷的转化率(填“减小”、“增大”或“不变”)。
-
15、化学反应常伴随能量变化,研究其能量变化有利于服务人类。(1)、一种即热饭盒的结构如图,这种饭盒使用起来非常方便,撤去底部的隔板几分钟后,饭菜就变热了。
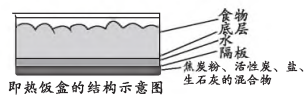
该即热饭盒“起热”原因主要与(填化学方程式)反应为放热反应有关。
(2)、中和反应的热量变化,其数值Q可通过如下量热装置测量反应前后体系温度变化,用公式计算获得。实验中用0.55 mol⋅L NaOH溶液和0.50 mol⋅L盐酸各50 mL进行反应热的测定。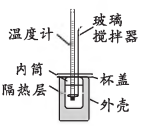
①实验中玻璃搅拌器的使用方法为(填“上下移动”、“左右移动”或“匀速旋转”)。
②实验中碱稍过量的原因为。
③实验测得反应前后体系的温度值分别为℃、℃,则该过程放出的热量为J[c和ρ分别取4.18J/(g⋅℃)和1.0 g⋅mL , 忽略水以外各物质吸收的热量,下同];实验发现,若用同体积同浓度的醋酸溶液代替实验中的盐酸,()℃减小,其原因为(用化学用语表示)。
(3)、查阅文献:反应 kJ⋅mol , 借鉴中和反应反应热的测定方法,某同学进行如下探究(忽略温度对焓变的影响)。实验结果见下表:序号
反应试剂
体系温度/℃
反应前
反应后
ⅰ
0.20 mol·L 溶液100 mL
1.36 g Zn
25
b
ⅱ
0.65 g Zn
25
c
①实验中应选择(填“Zn粉”或“Zn片”);温度:bc(填“>”“<”或“=”)。
②当时表明该方法可行。(保留1位小数)
-
16、向甲、乙、丙三个恒温密闭容器中充入一定量的A和B,发生反应(x为正整数): kJ⋅mol(),各容器的容积、反应温度、反应物起始量如表所示,
容器
甲
乙
丙
容积
1 L
1 L
1 L
温度/℃
反应物
起始量
3 mol A
1 mol B
3 mol A
1 mol B
6 mol A
2 mol B
其中甲、丙容器反应过程中C的浓度随时间变化关系如图所示:
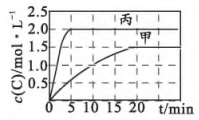
下列分析与推断错误的是( )
A、 B、不能判断、相对大小 C、平衡时乙容器中 mol⋅L D、该反应在℃下的化学平衡常数 -
17、25℃,将10 mL溶液中均相同HA、HB的两种溶液,加水稀释至1000 mL,溶液中随溶液体积的变化如图所示:
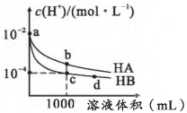
下列判断正确的是( )
A、HB是弱电解质 B、中和NaOH的能力:c>d C、该条件下能计算出电离平衡常数 D、a点溶液:、b点溶液点溶液 -
18、下列实验方案设计、现象和结论都正确的是( )
选项
目的
方案设计和现象
结论
A
证明是弱电解质
用pH计分别测量醋酸溶液和盐酸的pH,醋酸溶液的pH大
是弱电解质
B
探究压强对化学平衡的影响
先将注射器充满气体,然后将活塞往里推,注射器内气体颜色加深
加压,平衡向生成气体的方向移动
C
探究浓度对化学平衡的影响
向(黄色)溶液中缓慢滴加硫酸,溶液由黄色变为橙色
增大浓度,平衡向生成(橙色)方向移动
D
比较、催化分解的效率
向两份等浓度、等体积且等温的过氧化氢溶液中分别加入2滴等浓度的溶液和溶液,前者产生气泡较快
催化效率:
A、A B、B C、C D、D -
19、已知:C(石墨,s)在一定条件下可发生一系列变化,如图所示:

已知:。
下列说法错误的是( )
A、 B、 C、 D、C(石墨,s) -
20、已知:亚硝酸()是一种弱酸,亚硝酸钠()是一种常用的食品防腐剂。常温下,将0.1 mol⋅L 溶液加水稀释或加入少量晶体时,下列观点正确的是( )A、加水稀释时,电离平衡正向移动,溶液中增大 B、加晶体时,电离平衡逆向移动,溶液导电能力增强 C、加水稀释时,的电离程度增大,电离常数也增大 D、加晶体时,溶液的pH增大,与增大有关