-
1、用酸性高锰酸钾溶液与草酸()溶液反应来探究浓度和温度对反应速率的影响(假设溶液体积可以加和),设计的实验方案和得到的速率图像如下,下列说法错误的是( )
实验编号
室温下,试管中所加试剂及其用量/mL
实验温度/℃
溶液颜色褪至无色所需时间/min
0.6 mol·L 溶液
3 mol·L 溶液
0.05 mol·L 溶液
Ⅰ
2.0
2.0
3.0
20
2.6
Ⅱ
2.0
2.0
3.0
T
1.4
Ⅲ
2.0
3.0
2.0
3.0
45
1.0
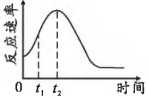 A、某同学认为也可以通过改变溶液的浓度探究浓度变化对速率的影响 B、后反应速率逐渐减小的原因是浓度变化对速率的影响为主要因素 C、实验Ⅲ中,从反应开始至溶液褪至无色时间段内, mol⋅L⋅min D、
A、某同学认为也可以通过改变溶液的浓度探究浓度变化对速率的影响 B、后反应速率逐渐减小的原因是浓度变化对速率的影响为主要因素 C、实验Ⅲ中,从反应开始至溶液褪至无色时间段内, mol⋅L⋅min D、 -
2、恒温恒容条件下,反应分两步进行,
①、②的能量-反应过程图如下所示。
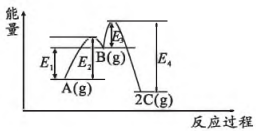
下列有关该反应的叙述正确的是( )
A、加入催化剂,减小 B、总反应的能量变化为 C、起始越大,A的转化率越高 D、反应②在升高温度时,平衡向逆反应方向移动 -
3、已知:各相关物质的燃烧热数据,如下表。
物质
燃烧热/(kJ·mol)
-393.5
-1366.8
-285.8
下列热化学方程式正确的是( )
A、 kJ⋅mol B、 kJ⋅mol C、 kJ⋅mol D、 kJ⋅mol -
4、将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在绝热条件下使其达到分解平衡:。能判断该反应已经达到化学平衡状态的是( )
①
②密闭容器中温度不变
③密闭容器中混合气体的密度不变
④断裂3 mol N-H键的同时形成1 mol 键
⑤密闭容器混合气体的总物质的量不变
⑥混合气体总质量不变
⑦密闭容器中的体积分数不变
A、①②③⑤⑦ B、②③④⑤⑥ C、①③④⑤⑥ D、②④⑤⑥⑦ -
5、有研究认为,强碱性溶液中反应分三步进行,其中两步如下:
第ⅰ步:
第ⅱ步:
下列说法正确的是( )
A、第ⅰ步反应能说明具有氧化性 B、第ⅲ步反应为 C、第ⅰ步反应表达式为 D、第ⅰ步反应为中和反应的逆反应,故比较大 -
6、工业合成氨生产中,为了提高原料气总平衡转化率,采取的措施正确的有( )
①增大压强;②选择高效催化剂;③及时分离出氨气;④将反应混合物中分离出的氢气和氮气进行循环操作
A、③④ B、①②③ C、①③④ D、①②③④ -
7、对 反应,下列观点正确的是( )A、1 mol 的总能量一定小于1 mol 和1 mol 的总能量 B、升高温度,减小、增大 C、增加C粉用量能加快反应速率 D、升高温度和增大压强均可增大活化分子百分数
-
8、下列叙述正确的是( )A、NaClO属于弱电解质 B、正丁烷异丁烷 , 正丁烷相对稳定 C、测量中和反应反应热的实验中,每次平行实验至少需要记录3次温度 D、根据是吸热反应,推测也是吸热反应
-
9、化学与生活、生产、环境息息相关。下列叙述错误的是( )A、食物放入冰箱中冷藏,其目的是减慢化学反应速率 B、选择合适的催化剂可有效减少汽车尾气中有害气体的排放 C、打开汽水瓶盖时有大量气泡冒出,该现象能用勒夏特列原理解释 D、煤的气化,有利于提供更多的能量,同时有效地减少温室气体的产生
-
10、某校化学兴趣小组为验证氯气的性质,设计如下实验(夹持装置已省略)。

已知:装置A中发生反应的化学方程式为(浓)。
回答下列问题:
(1)、写出装置B中反应的化学方程式:;实验结束后,立即取装置B中溶液滴在紫色石蕊试纸上,可观察到的现象是。(2)、装置C的实验目的是验证氯气是否具有漂白性,为此装置C中Ⅰ处应放入(填“干燥的有色布条”或“湿润的有色布条”)。(3)、装置D中多孔球泡的作用为;与石灰乳的反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是。(4)、装置E的作用是。(5)、可用于饮用水消毒。溶于水得到氯水,氯水中HClO的浓度越大杀菌能力越强。已知25℃时,氯水中(溶于水的氯气分子)、HClO、三种微粒所占百分数与溶液pH的关系如图所示。则用处理饮用水时,溶液的pH最佳控制范围是。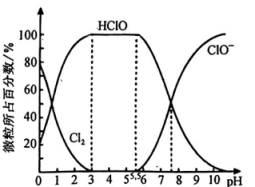
-
11、某澄清透明溶液中可能含 , , , , , , , 中的一种或几种(不考虑离子水解),现进行如下实验:
①用玻璃棒蘸取少量溶液滴在红色石蕊试纸上,试纸变蓝;
②取少量原溶液于试管中,逐滴滴加盐酸至过量,有气体放出;
③再向②所得溶液中加入溶液,没有沉淀生成;
④再向③所得溶液中滴加足量硝酸酸化后,加入溶液,有白色沉淀生成。
回答下列问题:
(1)、根据步骤①可以推断原溶液中一定含有 , 一定不含有。(2)、步骤②发生反应的离子方程式为。(3)、根据步骤②、③可以推断出原溶液中一定含有 , 一定不含有。(4)、步骤④中产生的白色沉淀为(填化学式)。(5)、通过步骤④不能确定原溶液中含有 , 其原因是。 -
12、氧化还原反应是一类重要的化学反应,广泛存在于生产、生活中。回答下列问题:
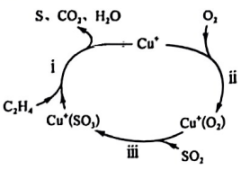 (1)、以乙烯()脱硫的方法治理燃煤尾气中的 , 其机理如图所示。过程Ⅰ、Ⅱ、Ⅲ中涉及氧化还原反应的是 , 图中涉及的物质属于酸性氧化物的是(填化学式)。(2)、某工业废水含有大量对人体健康有危害的 , 为了降低废水中的浓度,可以在碱性条件下用铝粉将转化为 , 其化学方程式为。
(1)、以乙烯()脱硫的方法治理燃煤尾气中的 , 其机理如图所示。过程Ⅰ、Ⅱ、Ⅲ中涉及氧化还原反应的是 , 图中涉及的物质属于酸性氧化物的是(填化学式)。(2)、某工业废水含有大量对人体健康有危害的 , 为了降低废水中的浓度,可以在碱性条件下用铝粉将转化为 , 其化学方程式为。①中Al的化合价为。
②上述反应中,被氧化的元素是(填元素符号),被氧化的元素(填“得到”或“失去”)电子;还原产物的化学式为。
③反应中每生成1个 , 转移个电子。
(3)、“假黄金”实际上是铜合金,可用稀硝酸鉴别。配平该反应的化学方程式(稀):。(4)、已知、 , 均有还原性,它们在酸性溶液中会发生如下反应:①
②
③
则、 , 的还原性由强到弱的顺序为(用“>”连接)。
-
13、钠及其化合物在日常生活中有许多重要应用。回答下列问题:
Ⅰ.如图为钠的价类二维图。
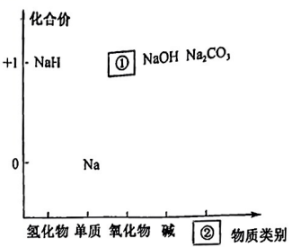 (1)、Ⅰ.如图为钠的价类二维图。
(1)、Ⅰ.如图为钠的价类二维图。
若①处是淡黄色固体,其化学式为 , ②处所属的物质类别为。 (2)、氢化钠(NaH)能与水反应生成氢氧化钠和氢气,写出该反应的化学方程式:。(3)、钠钾合金可用作原子反应堆的导热剂的原因除了钠钾合金是难气化的液态合金,还有可能是。(4)、Ⅱ.我国化学家侯德榜发明了联合制碱法(),对世界制碱工业做出了巨大贡献。联合制碱法的主要流程如图所示(部分物质已略去,极易溶于水,其水溶液呈碱性)。
(2)、氢化钠(NaH)能与水反应生成氢氧化钠和氢气,写出该反应的化学方程式:。(3)、钠钾合金可用作原子反应堆的导热剂的原因除了钠钾合金是难气化的液态合金,还有可能是。(4)、Ⅱ.我国化学家侯德榜发明了联合制碱法(),对世界制碱工业做出了巨大贡献。联合制碱法的主要流程如图所示(部分物质已略去,极易溶于水,其水溶液呈碱性)。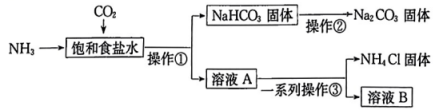
流程图中标注的物质属于电解质的有种,①~③所涉及的操作方法中,包含过滤的是(填序号)。
(5)、煅烧固体的化学方程式为。(6)、关于上述流程,下列说法中正确的是(填字母)。a.两种气体的先后顺序为先通入再通入
b.先析出的原因是的溶解度小于
c.整个流程中涉及氧化还原反应
d.溶液B中的主要离子为 , , ,
-
14、“宏观辨识—微观探析——符号表征”是化学学习的重要方法。某化学反应的微观示意图如下,下列分析错误的是( )
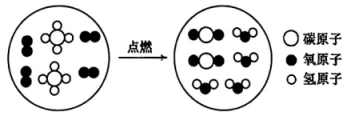 A、该反应属于氧化还原反应 B、
A、该反应属于氧化还原反应 B、 为温室气体
C、该反应实现了无机物向有机物的转化
D、该反应的化学方程式为
为温室气体
C、该反应实现了无机物向有机物的转化
D、该反应的化学方程式为
-
15、某溶液只含有、、、四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中和的离子个数比为( )A、1∶1 B、2∶3 C、3∶4 D、5∶2
-
16、物质的性质决定用途,下列物质的性质与其用途正确且具有对应关系的是( )A、盐酸具有挥发性,可用于除铁锈 B、NaCl熔点高,可用于食品防腐 C、乙醇具有可燃性,可用作燃料 D、具有强还原性,可用于自来水消毒
-
17、下列离子方程式中书写正确的是( )A、向中滴加少量稀盐酸: B、向NaOH溶液中通入少量: C、向水中投入一小块钠: D、向水中投入少量:
-
18、钠元素广泛存在于自然界,下列关于钠及其化合物的叙述正确的是( )A、金属钠着火时,可用二氧化碳来扑灭 B、将少量钠投入氯化镁溶液中,可得到金属镁 C、用碳酸氢钠溶液做焰色试验,焰色为黄色 D、可用澄清石灰水鉴别碳酸钠和碳酸氢钠溶液
-
19、下列实验或装置不能达到实验目的的是( )
A
B
C
D


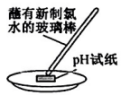

验证NaCl是否是电解质
比较碳酸钠和碳酸氢钠的热稳定性
测定新制氯水的pH
区分溶液与胶体
A、A B、B C、C D、D -
20、下列各组离子在溶液中能大量共存的是( )A、、 , , B、、 , 、 C、 , 、 , D、、 , ,