-
1、为五种不同的核素,化合物和所含元素相同,相对分子质量相差7.含质子,和三种元素位于同周期且的质子数为质子数之和的一半,原子最外层电子数是其核外电子层数的两倍。下列说法不正确的是( )A、原子半径: B、的简单氢化物标准状况下均为气态 C、和互为同位素 D、和的单质均为空气中的成分
-
2、下列关于物质结构或元素周期律(表)的说法中正确的是( )A、短周期主族元素的比较原子半径时,核外电子层数多的均大于核外电子层数少的 B、短周期中具有相同电子层结构的简单离子比较半径时,核电荷数大的离子半径小 C、在化合物分子中,由同种原子形成共价键都是非极性共价键,简称非极性键 D、除之外的短周期主族非金属元素均满足:最高正价最低负价
-
3、为了纪念人类历史上那些做出过伟大科学成就的科学家,许多国家都发行过纪念他们的邮票。下列邮票中的科学家与其对应描述不相符的是( )A、拉瓦锡提出了第一个元素分类表
 B、门捷列夫编制了第一张元素周期表
B、门捷列夫编制了第一张元素周期表 C、卢瑟福提出了原子的有核模型
C、卢瑟福提出了原子的有核模型 D、维尔纳发现并证明原子序数等于核电荷数
D、维尔纳发现并证明原子序数等于核电荷数
-
4、下列化学用语或模型表示不正确的是( )A、保持干冰化学性质的最小微粒的结构模型:
 B、VIA族元素中非金属性最强元素的原子结构示意图:
B、VIA族元素中非金属性最强元素的原子结构示意图: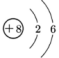 C、侯氏制碱法得到的可用作化肥的副产品的电子式:
C、侯氏制碱法得到的可用作化肥的副产品的电子式: D、天然气主要成分的分子结构式:
D、天然气主要成分的分子结构式:
-
5、2023年诺贝尔化学奖颁发给了研究量子点的三位科学家,其研究成果表明,物质在纳米级时因微粒大小不同而具有不同的颜色、性质,它们的研究在医疗、科技等多个领域有重大意义。下列叙述正确的是( )A、科学家研究过程中制得了直径为的CdS,这种CdS是一种胶体 B、利用丁达尔效应鉴别胶体和淀粉溶液 C、胶体区别于其他分散系的本质特征是分散质粒子直径为 D、可以通过渗析方法分离胶体和泥沙水的混合物
-
6、2023年入冬以来,呼吸道感染性疾病的发病率逐渐升高,为确保同学们的身体健康,学校要求各班每日做好通风、消杀工作。每日消杀所用“84消毒液”的有效成分为( )A、二氧化氯 B、次氯酸钠 C、次氯酸钙 D、过氧乙酸
-
7、钛酸钡是一种压电材料,主要用于电子陶瓷、PTC热敏电阻、电容器等多种电子元器件的制备。某工厂以重晶石为原料,生产的工业流程如下图:

已知常温下: , 。
回答下列问题:
(1)、为提高的酸浸速率,可采取的措施为(写出一条)。(2)、转化过程中溶液中钛元素在不同pH时主要以、、这三种形式存在(变化曲线如右图所示)。实际制备工艺中,先用氨水调节混合溶液的pH为 , 再进行转化,理由是。(3)、工业上用饱和溶液处理重晶石(假设杂质不与溶液作用),待达到平衡后,移走上层清液,重复多次操作,将转化为 , 此反应的平衡常数K=(填写计算结果)。若不考虑的水解,要使恰好完全转化为 , 则至少需要浓度为溶液mL。(4)、在隔绝空气条件下,煅烧草酸氧钛钡晶体时有两种气体(水蒸气除外)生成,该反应的化学方程式为。流程中用而不用其它酸的理由是。 -
8、三草酸合铁酸钾晶体(M=491g/mol)是一种感光剂和高效的污水处理剂,是制备负载型活性铁催化剂的主要原料,还可以作为一些有机反应的催化剂。
I.制备的途径如下,请回答下列问题:

研究小组通过查阅资料得知:
a.对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如、)难溶于水,但能溶解于稀硝酸。
请回答:
(1)、步骤③中,控制水浴温度在40℃左右的原因为。(2)、关于制备流程,下列说法正确的是____A、步骤①为复分解反应,步骤③为氧化还原反应 B、步骤②判断是否洗涤干净,可以取少量最后一次洗涤液,加入氯化钡溶液,观察是否有白色沉淀产生 C、步骤④,加入乙醇目的在于降低的溶解度,使其结晶析出 D、步骤④⑤可以在日光下进行(3)、Ⅱ.测定三草酸合铁酸钾样品(含少量)的纯度,进行如下实验:步骤1:称取5.000g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤2:取25.00mL溶液,用酸性溶液滴定至终点,消耗12.30mL。
步骤3:另取25.00mL溶液,加入过量Zn粉,将还原成 , 过滤,洗涤,将滤液和洗涤液合并。
步骤4:用酸性溶液滴定合并后溶液至终点,测得实验数据:
实验次数
滴定前读数/mL
滴定后读数/mL
1
0.10
14.90
2
0.52
14.82
3
0.00
16.66
4
0.30
14.10
步骤1中所需玻璃仪器除烧杯、玻璃棒、量筒外还有(填仪器名称)。
(4)、研究小组制得的纯度为。 -
9、油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:(1)、已知下列反应的热化学方程式:
①
②
③
计算热分解反应④的kJ/mol,该反应在(填“高温”或“低温”)条件下才可自发进行。
(2)、某恒温恒容条件下,反应④中的转化率达到最大值的依据是____(填字母)。A、气体的压强不发生变化 B、气体的密度不发生变化 C、平均摩尔质量不发生变化 D、单位时间里分解的和生成的H2的量一样多(3)、目前较普遍采用的处理方法是克劳斯工艺:①相比克劳斯工艺,利用反应④高温热分解方法的优缺点是。
②研究人员对反应条件对产率的影响进行了如图研究。同条件下,相同时间内,产率随温度的变化如图1所示。由图1可见,随着温度升高,产率先增大后减小,原因是。

③相同条件下,相同时间内,产率随值的变化如图2所示。值过高不利于提高产率,可能的原因是。
(4)、在1470K、100kPa反应条件下,将的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为 , 平衡常数kPa(已知:分压=总压×该组分的物质的量分数)。 -
10、二氧化氯(黄绿色易溶于水的气体)是绿色消毒剂,实验室用如图方法制备:
 (1)、与在溶液中恰好反应生成的离子方程式为。(2)、下列说法正确的是____。A、气体A是 B、消毒是通过缓慢释放的HClO作用的,其消毒的持久力强 C、电解的阳极方程式为: D、除去中的气体B可用碱石灰,也能用无水氯化钙(3)、写出与水反应的化学方程式。(4)、、、的沸点由高到低的顺序是 , 你的理由是。(5)、假设恰好完全反应,气体全部逸出,设计实验检验溶液C中所有阴离子。
(1)、与在溶液中恰好反应生成的离子方程式为。(2)、下列说法正确的是____。A、气体A是 B、消毒是通过缓慢释放的HClO作用的,其消毒的持久力强 C、电解的阳极方程式为: D、除去中的气体B可用碱石灰,也能用无水氯化钙(3)、写出与水反应的化学方程式。(4)、、、的沸点由高到低的顺序是 , 你的理由是。(5)、假设恰好完全反应,气体全部逸出,设计实验检验溶液C中所有阴离子。 -
11、氢能在21世纪有可能在世界能源舞台上成为一种举足轻重的能源,氢的制取、储存、运输、应用技术也将成为21世纪备受关注的焦点。(1)、氨硼烷含氢量高、热稳定性好,是具有潜力的固体储氢材料。
①氨硼烷中N为价,B为+3价。H、B、N的电负性由大到小依次为。
②氨硼烷在催化剂作用下水解释放氢气 , 的结构如图1所示,在该反应中,B原子的杂化轨道类型由变为。

③Crabtree等报道了26种分子间存在双氢键X-H…H-Y(即H与H之间形成类氢键)。已知氨硼烷分子间也存在“双氢键”使氨硼烷的熔点明显升高,请分析“双氢键”能形成的原因是。
(2)、是种新型储氢材料,其中可由和结合而成。BH1含有(填序号)①键②键③氢键④配位键⑤离子键
(3)、某种新型储氢材料的晶胞如图2所示,八面体中心为M金属离子,顶点均为配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为 , 则在该化合物中,M离子的价电子排布式为 , 该化合物的化学式是。 -
12、下列实验探究方案能达到探究目的是( )
探究方案
探究目的
A
分别向溶液中加2mL0.1mol/L溶液和的溶液,观察溶液褪色的快慢
探究反应物浓度对化学反应速率的影响
B
分别向浓度均为含有和的三种溶液中逐滴加入的溶液,观察产生沉淀的先后顺序
比较、、大小
C
分别测浓度均为的和溶液的pH值,比较两者pH的大小
比较和的水解常数
D
向溶液中加入溶液,充分反应后用苯萃取2~3次,取水层滴加KSCN溶液,观察溶液颜色变化
与的反应有一定限度
A、A B、B C、C D、D -
13、已知:、分别为一元弱碱和一元弱酸,二者在水中电离方程式分别为:; , 25℃时,将10mL浓度均为的、两种溶液分别加水稀释,曲线如图所示,V是溶液体积(mL), , 下列说法正确的是( )
 A、 B、水的电离程度: C、溶液中的阴、阳离子总浓度: D、常温下,向上述pOH=3的溶液加入等体积pH=3的盐酸后呈中性
A、 B、水的电离程度: C、溶液中的阴、阳离子总浓度: D、常温下,向上述pOH=3的溶液加入等体积pH=3的盐酸后呈中性 -
14、下面是丙烷(用表示)的氯化和溴化反应时的相对能量变化图(已知)及产率关系。有关说法不正确的是( )
 A、完全生成放热 B、比稳定 C、以丙烷、卤素、氢氧化钠溶液为原料制备2-丙醇,优于 D、溴代和氯代第一步都是决速反应
A、完全生成放热 B、比稳定 C、以丙烷、卤素、氢氧化钠溶液为原料制备2-丙醇,优于 D、溴代和氯代第一步都是决速反应 -
15、砷化镓是一种重要的半导体材料,熔点1238℃。它在600℃以下,能在空气中稳定存在,并且不被非氧化性的酸侵蚀。砷化镓晶胞结构如图。下列说法正确的是( )
 A、砷化镓是一种分子晶体 B、砷化镓中不存在配位键 C、基态As原子的价电子排布式为 D、晶胞中Ga与周围等距且最近的As形成的空间正四面体
A、砷化镓是一种分子晶体 B、砷化镓中不存在配位键 C、基态As原子的价电子排布式为 D、晶胞中Ga与周围等距且最近的As形成的空间正四面体 -
16、一种光辅助可充电钠离子电池利用水系的电解液和NaI电解液分别作为电池的活性物质,并且将光电极嵌入到新型钠离子电池的正极,作为太阳能转化及存储基元。下列关于该电池的说法错误的是( )
 A、放电时,a电极的电极反应式为: B、充电时,光电极的电极反应式为: C、放电时,钠离子从右向左迁移 D、充电时,太阳能转化为电能,电能又转化为化学能
A、放电时,a电极的电极反应式为: B、充电时,光电极的电极反应式为: C、放电时,钠离子从右向左迁移 D、充电时,太阳能转化为电能,电能又转化为化学能 -
17、中国科学家研究在Pd/SVG催化剂上H2还原NO生成N2和NH3的路径,各基元反应及活化能Ea(kJ·mol-1)如图所示,下列说法错误的是( )
 A、生成NH3的各基元反应中,N元素均被还原 B、在Pd/SVG催化剂上,NO更容易被H2还原为NH3 C、决定NO生成NH3速率的基元反应为NH2NO→NHNOH D、生成NH3的总反应方程式为2NO+5H22NH3+2H2O
A、生成NH3的各基元反应中,N元素均被还原 B、在Pd/SVG催化剂上,NO更容易被H2还原为NH3 C、决定NO生成NH3速率的基元反应为NH2NO→NHNOH D、生成NH3的总反应方程式为2NO+5H22NH3+2H2O -
18、已知HA是挥发性强酸,下列叙述正确且能说明HB是弱酸的是( )A、HA和HB都可用相应的钠盐与浓硫酸反应制取 B、相同pH的HA和HB分别跟铁反应时,产生氢气的起始速率相等 C、相同pH的HA和HB溶液中分别加入相应的钠盐固体,HB的pH变大 D、将pH均为3的HA和HB,都稀释成的溶液,HB所需加入水的量少
-
19、三聚的结构如图所示,下列关于三聚的推测合理的是( )
 A、S原子的杂化方式与分子中原子的杂化方式相同 B、S原子与O原子间的键长均相同 C、自发转变为三聚的过程放热 D、在水中的溶解度较小
A、S原子的杂化方式与分子中原子的杂化方式相同 B、S原子与O原子间的键长均相同 C、自发转变为三聚的过程放热 D、在水中的溶解度较小 -
20、下列说法正确的是( )A、溶液中: B、常温下,溶液与溶液混合,经充分反应后,如果溶液体积为 , 则溶液 C、相同条件下的①溶液 ②溶液 ③稀盐酸,三种溶液中由水电离产生的:①>②>③ D、常温下,将稀溶液与溶液混合,可能出现 , 且的情况